CITA ESTE TRABAJO
Caballero-Mateos AM, Bailón-Gaona MC, Cañadas-de la Fuente GA, López-Hidalgo J, Caballero-Plasencia AM. Dilataciones de los Espacios Intercelulares como Marcador Histológico en la Enfermedad por Reflujo Gastro-Esofágico: Puesta al Día. RAPD 2025;48(5):177-195. DOI: 10.37352/2025485.1
1. Definición y procedimientos diagnósticos de la Enfermedad por Reflujo Gastro-Esofágico
La Enfermedad por Reflujo Gastro-Esofágico (ERGE) es una enfermedad muy frecuente con prevalencias que varían según la latitud considerada. En la población general de los países occidentales la prevalencia es 10-20% y, en menor cuantía, aunque creciendo, en Asia[1]. La ERGE se produce cuando el contenido del estómago (ácido, alcalino o gaseoso) refluye hacia el esófago produciendo síntomas (pirosis y/o regurgitación) y/o complicaciones (esofagitis, estenosis, esófago de Barrett y adenocarcinoma). Los síntomas solo se consideran cuando afectan al bienestar del sujeto; los síntomas leves, infrecuentes y poco relevantes pueden presentarse hasta en el 40% de la población general y no deben considerarse ERGE. Por ello, suelen utilizarse cuestionarios que solo consideran ERGE si la presencia de síntomas es de suficiente intensidad/frecuencia[2],[3].
Definición clínica. Consensos de Montreal, Lyon y Los Ángeles
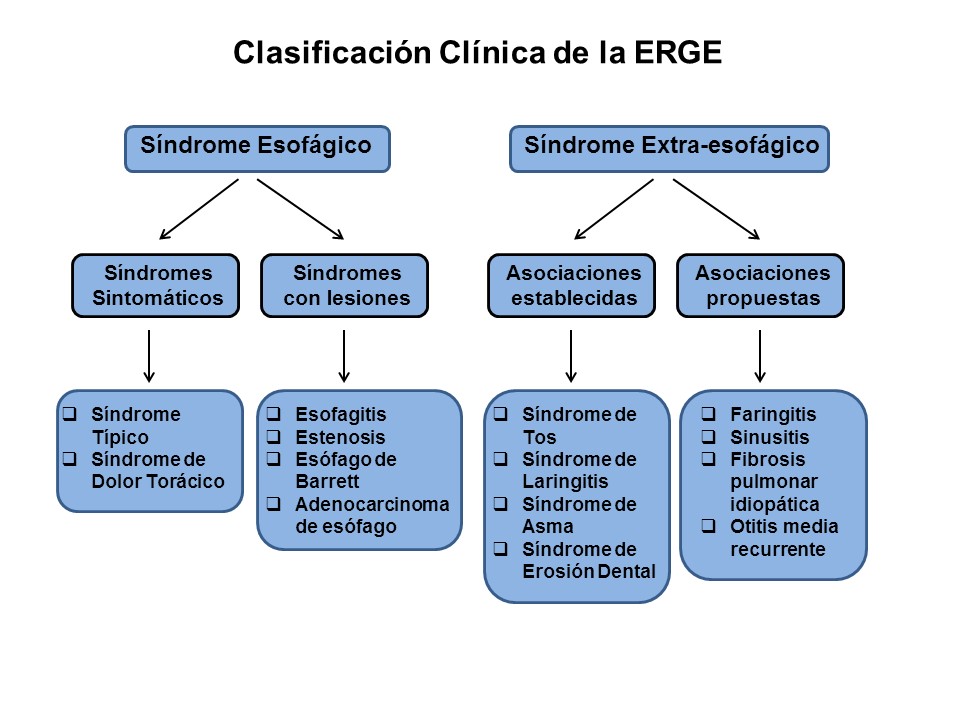
El Consenso de Montreal[3] propone que la ERGE consta de unos síndromes esofágicos (síndrome sintomático y síndrome con lesiones endoscópicas) y unos síndromes extra-esofágicos, con asociación establecida o propuesta (Figura 1) .
Gracias a los Consensos de Montreal y Lyon I y II[3]-[5], ha quedado establecida, de una forma lo más precisa posible, la definición de ERGE. Este hecho, aparentemente banal, es de gran importancia al acotar lo máximo posible el espectro clínico de la ERGE que, hasta el momento, había mostrado una variabilidad que impedía el correcto diseño y comparación de las investigaciones. En lo referente a la endoscopia digestiva alta (EDA), este trabajo de consenso ya se había logrado tras la aceptación de los criterios de Los Ángeles para las lesiones esofágicas inducidas por el reflujo gastro-esofágico (RGE)[6]. La EDA tiene una elevada especificidad (≈100%) para el diagnóstico de ERGE, pero baja sensibilidad pues, aproximadamente 2/3 de los pacientes con síntomas de ERGE, no tienen lesiones endoscópicas[7]-[9]. Hasta este punto, se ha conseguido con suficiente fiabilidad el diagnóstico clínico y endoscópico de ERGE, ya que nos permite dividir a estos pacientes en: 1) portadores de una ERGE con lesiones endoscópicas (grados A-D de los Ángeles) o ERGE Erosiva (EE), y 2) los que no presentan lesiones endoscópicas o son mínimas (grado N y M de los Ángeles) o ERGE no erosiva (ENE).
Estudio de la calidad y cantidad del material refluído
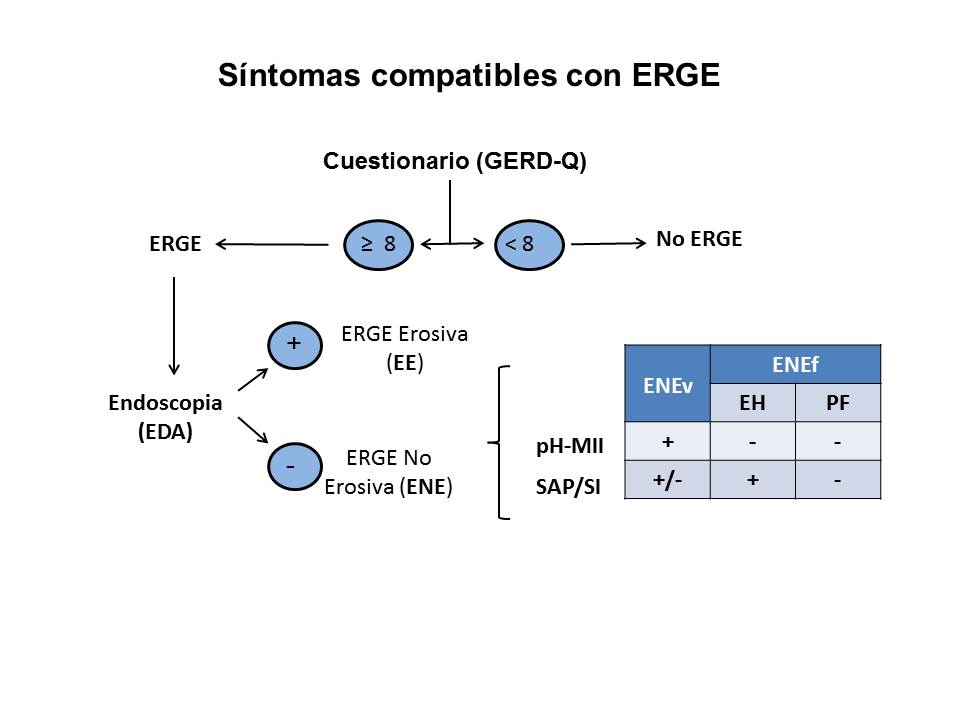
Tras la práctica de una EDA, empiezan los problemas metodológicos para el estudio de los diferentes fenotipos de las ENE. Siguiendo el protocolo, la prueba diagnóstica a efectuar en este momento sería, siempre que se pueda, una prueba combinada, la pHmetría ± Impedanciometria intraluminal multicanal de 24 h (pH-MII), que permite analizar tanto el RGE ácido como alcalino. Esta prueba subdivide la ENE en: ENE "verdadera" (ENEv), si la pH-MII es patológica y ENE "funcional" (ENEf), si la pH-MII es normal. Se ha comunicado que entre el 37-60% de la ENE totales tienen pHmetría normal, lo que debería corresponder al porcentaje de pacientes con ENEf7. Hoy en día, tras los criterios de Roma IV[7], la ENEf no forma parte de la ERGE, al considerarse un proceso funcional del esófago y, por ello, parte del espectro de los Trastornos de las Interacciones Cerebro-Intestino (TICI). Las ENEf están constituidas por dos entidades: el Esófago Hipersensible (EH) cuando la SAP/SI (Symptom Association Probability y Symptom Index, pruebas que relacionan los episodios de RGE con la aparición de síntomas de ERGE) son positivas, y la Pirosis Funcional (PF), cuando SAP/SI son negativas (Figura 2). La pH-MII consigue diferenciar ENEv de ENEf y, por ello, a falta de mejores procedimientos (sobre todo más sensibles), se la considera el "patrón oro" o de referencia (gold standard) entre las pruebas diagnósticas de la ERGE. No obstante, la pHmetría sin impedanciometría asociada, tiene algunos problemas:
Figura 2
Diagnóstico actual de la ERGE (ENEv = ENE “verdadera”; ENEf = ENE “funcional”; EH = Esófago hipersensible; PF = Pirosis funcional; pHMII = pHmetría ± Impedanciometría de 24 h.; SAP/SI = Probabilidad de asociación síntomas-reflujo/Índice sintomático).
- Déficit de sensibilidad, al haberse comprobado en la EE hasta un 23-34% de falsos negativos[8],[10],[11], aunque con una buena especificidad (85-100%)[7],[12]. Recientemente, se ha demostrado que determinadas formas de pepsina pueden ser activas a pH más elevados justificando algunas pHmetría normales en pacientes con EE. Este hallazgo podría tener importancia en la ENE con RGE levemente ácido o en pacientes estudiados bajo tratamiento con IBP[13],[14].
- Variabilidad intra-individual, lo que explica que un día un paciente o control tenga una pHmetría patológica y, en otro día cercano, tenga pHmetría normal, o viceversa. Este hecho entra dentro de lo lógico, al ser el RGE un proceso dinámico, impredecible e intermitente, dependiente de múltiples factores (dieta, postura, relajaciones transitorias del EEI, estrés, ejercicio, motilidad, aclaramiento esofágico, etc.)[15].
- El Consenso de Lyon II5 establece como valores patológicos de RGE cuando el pH es < 4, durante > 6% del tiempo de registro (24h). Hasta entonces se habían considerado valores patológicos porcentajes del > 4%, > 5.5% (con un borderline entre 3.5-5.5%)[10],[16] o puntuación de DeMeester ≤ 14,72[17]. Por lo tanto, los estudios han considerado de forma muy variable lo que es un RGE patológico o normal. Así, las frecuencias de ENEv y ENEf han variado ampliamente según el método, momento, referencia e investigador considerados.
- Es una prueba invasiva, incómoda para el paciente, consume mucho tiempo, tiene un elevado coste y, lo más importante, no está disponible en muchos centros hospitalarios, como los hospitales comarcales.
Un último paso, la evaluación del estado de la mucosa esofágica
La última prueba diagnóstica a considerar en la ERGE es el estudio histológico de las biopsias esofágicas, procedimiento minimizado en las últimas décadas y cuya utilidad se ha reactivado en los últimos años. La mucosa esofágica, compuesta por un epitelio escamoso estratificado parcialmente queratinizado (parecido al de la piel), tiene tres capas: 1) La más superficial, luminal o funcional, es el estrato córneo. 2) La capa media o estrato espinoso (prickle) contiene las células que, unidas por desmosomas, van diferenciándose y migrando hacia el lecho funcional[18]. 3) La capa más profunda, basal o germinativa, es donde se encuentran las células en división que, posteriormente, renovarán el epitelio. Aunque el estudio al microscopio óptico (MO) de la mucosa esofágica es antiguo, no fue hasta principios de los años 70 cuando se comunican varias alteraciones elementales relacionadas con el daño inducido por el RGE[19]. Tras un amplio y prolongado debate, los últimos estudios han concluido que no existen lesiones o conjunto de lesiones exclusivamente inducidas por el RGE, ya que carecían de la especificidad (la hiperplasia de la capa basal, elongación de papilas e infiltrado inflamatorio intraepitelial linfoide) y/o sensibilidad (erosiones/necrosis, infiltrados intraepiteliales de neutrófilos y eosinófilos) necesarias para un correcto diagnóstico de ERGE microscópica o Esofagitis Microscópica (Em)[12],[16],[20]-[23]. No obstante, se debe considerar que gran parte de las diferencias entre los diversos estudios son de tipo metodológico[24]: Escaso número de pacientes, diferentes criterios para definir la ERGE, esporádica realización de EDA y/o pH-MII, deficitaria selección del grupo control (incluiría una correcta definición de ERGE, práctica de EDA, pH-MII e, incluso, una manometría), distribución "en parches" de las lesiones (obliga a tomar varias biopsias), reproductibilidad de la observación (variaciones inter-observador), ausencia de período de "lavado" de IBP (≈ 4 semanas), definición del número y lugar en donde tomar las biopsias (recomendable tomarlas en la unión escamo-columnar o línea "Z" o, mejor aún, en los 2 cm más proximales a ella, a las 3 horarias y preferentemente en zonas enrojecidas)[25]-[29], correcta orientación de las biopsias (esencial para evaluar la hiperplasia de la capa basal y elongación de las papilas). Algunos parámetros aceptados como expresión del daño por RGE no están suficientemente consensuados (se han considerado excesivos los límites patológicos de ≥ 15% de la hiperplasia de la capa basal y ≥ 2/3 del grosor total en la elongación de papilas[19],[20],[30]-[35]) y, finalmente, el importante consumo de tiempo cuando se utilizan métodos cuantitativos, como los propuestos por Zentilin et al.[16] y el EsoHisto Proyect[20],[22].
Todas estas son las razones por las que, aunque se siguen utilizando en la práctica diaria, los parámetros sobre los que se basa el diagnóstico histológico de la ERGE estén en entredicho.
El hallazgo de las Dilataciones de los Espacios Intercelulares (DEI)
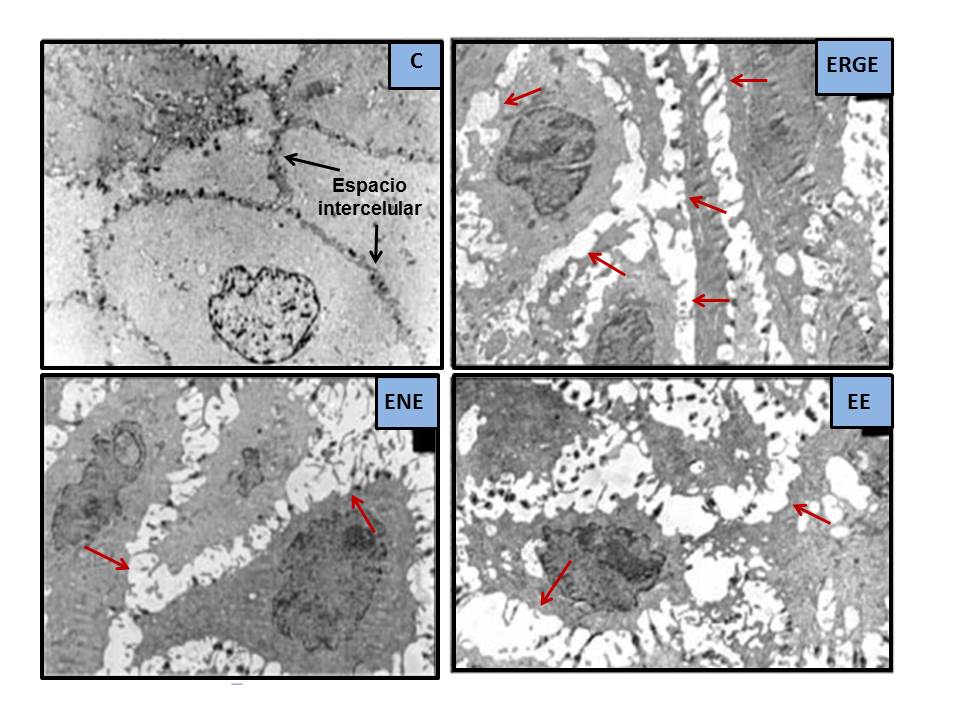
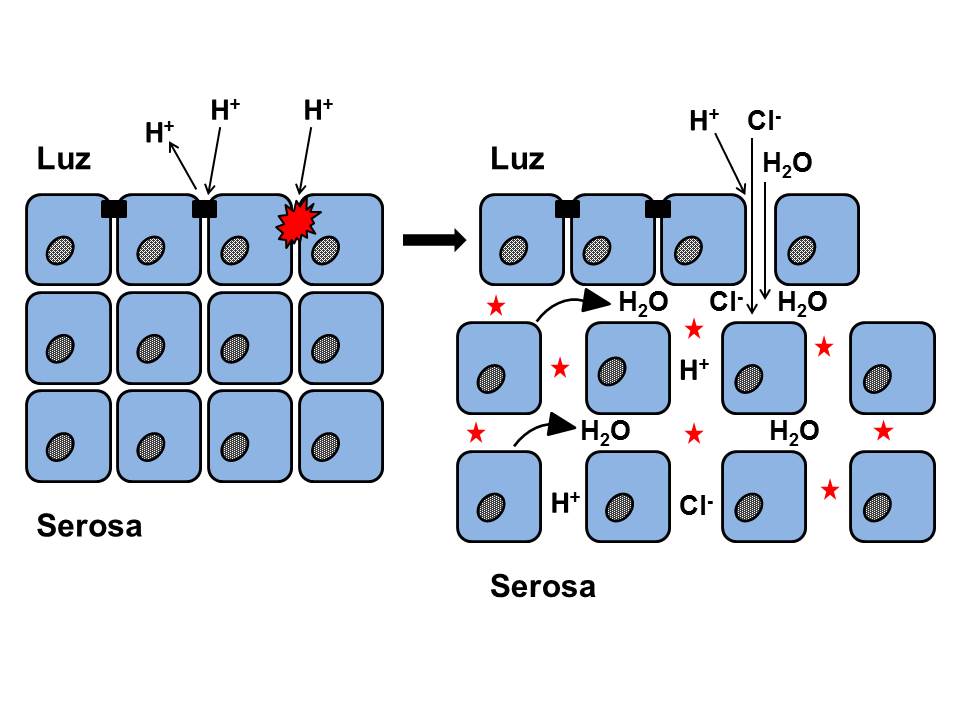
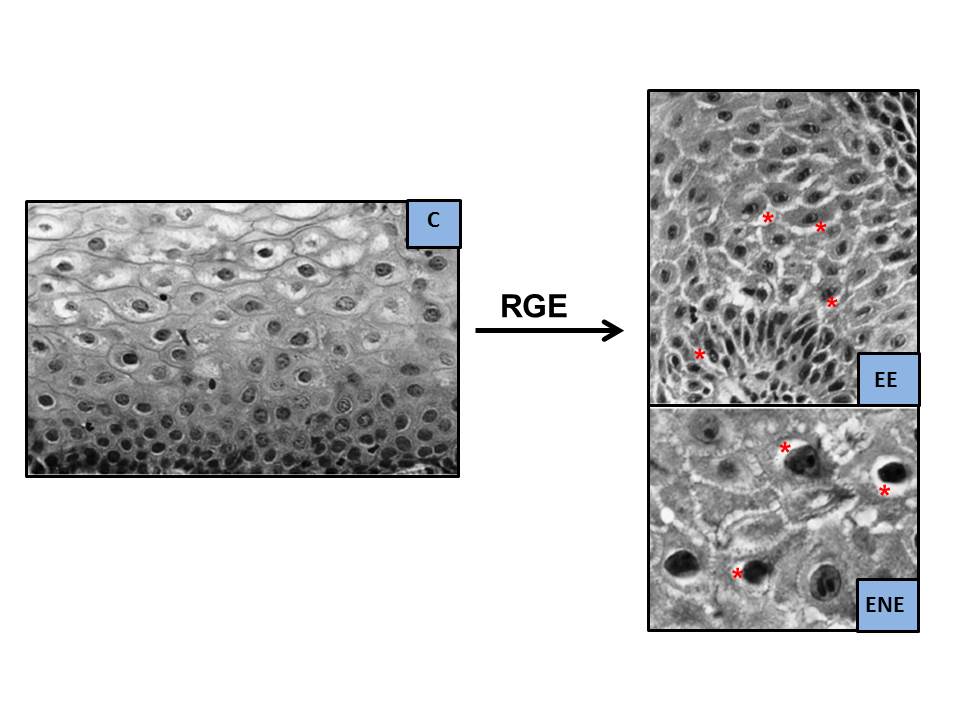
A finales de los años 70 del siglo pasado, habiéndose apreciado previamente en estudios experimentales[36], Poppe en 1978[37] y Hopwood en 1979[38] describieron, por primera vez en humanos, unas alteraciones al microscopio electrónico (ME) que consideraron como consecuencia del efecto lesivo del RGE sobre la mucosa esofágica. Se trataba de unas Dilataciones de los Espacios Intercelulares (DEI), más aparentes en el lecho más basal y, en menor grado, en el escamoso y espinoso. Posteriormente, estos hallazgos fueron confirmados en 1996 por Tobey et al.[39], mediante ME de transmisión y un laborioso método de medida (Figura 3). Apreciaron que las DEI tenían un diámetro máximo medio ≥ 2.4 µm en el 73% de los 11 pacientes con pirosis (vs. 0% en 13 controles, 0.46 µm), sin apreciar diferencias significativas entre aquellos con EE (55% de los pacientes, 0.80 µm) o ENE (45% de los pacientes, 1.0 µm); quizás debido al escaso número de casos evaluados y que en aquellos con EE la biopsia se tomó de zonas no lesionadas (siempre en los 5 cm más distales). La sensibilidad del procedimiento para diferenciar ERGE vs. controles, basada en el valor de ≥ 2.4 µm, fue del 73% y la especificidad del 100%. Posteriormente, se confirmó que, en el hombre sano asintomático, el espacio intercelular analizado en la capa superficial o estrato córneo es más estrecho y variable, entre 0.45-0.56 µm, que en las otras dos capas más profundas[40],[41] (Tabla 1). El grupo de Tobey et al.[39] postuló que estas DEI serían consecuencia de una mayor permeabilidad paracelular al ácido, consecuencia del daño inducido por éste en las membranas de las células epiteliales, empeorando el transporte del sodio y acumulándose el agua en el espacio intercelular[36] (Figura 4). Si los mecanismos que provocan la lesión están equilibrados con los de reparación no existirá lesión (ENE); por el contrario, si aquéllos superan a estos últimos, aparecería la EE[41]. Se ha comprobado que las DEI son más frecuentes en el esófago de Barrett vs. EE[42] y en la EE vs. ENE, por lo que podrían considerarse como unos signos precoces de esofagitis o de la intensidad del daño mucoso. En este sentido, la medida de las DEI podría ser útil para reconocer qué ENE podrían evolucionar a EE, pues se conoce que, aproximadamente, un 15-89% de los pacientes con ENE puede evolucionar en 4-10 años a EE; aunque también se han detectado regresiones en el tiempo[43]-[47].
Figura 3
Dilataciones de los Espacios Intercelulares al ME (modificado de Calabrese et al.[76], 2003. DEI = formaciones arrosariadas, de color blanco al ME, señaladas con flechas rojas. Están ausentes en el sujeto control asintomático [C] y presentes en pacientes con pirosis intensa [ERGE], ERGE No Erosiva [ENE] o ERGE Erosiva [EE]).
Figura 4
Ruptura de las uniones intercelulares proteicas (tight junctions, uniones adherentes y desmosomas) por el ácido intraluminal concentrado (H+), disminución de la resistencia mucosa (impedancia) y aumento de la permeabilidad paracelular. La entrada paralela de altas concentraciones de Cl- hacia los espacios intercelulares induce un gradiente osmótico, lo que arrastra el agua hacia ellos produciendo su dilatación; son las DEI (asteriscos). Figura de elaboración propia.
Tabla 1
Principales estudios que han evaluado las Dilataciones de los Espacios Intercelulares (DEI) (* significativo vs. control; Ø = diámetro medio o máximo, en µm; ME = microscopio electrónico; MO = microscopio óptico; ENE = ERGE no erosiva; ENEv = ERGE no erosiva “verdadera” o con pHmetría positiva; EE = ERGE erosiva; C = control; EH = esófago hipersensible; PF = pirosis funcional; Bx = biopsia; PL = período de lavado de IBP; SS-ESP = sensibilidad-especificidad; UGE = unión gastro-esofágica; CaE = carcinoma de esófago).
| Estudio | Tipo de observación | Dilataciones de los Espacios Intercelulares (DEI) | |||||
| Ø medio o máximo de los DEI (µm) | % pacientes con DEI | ||||||
| ENE | EE | Control | ENE | EE | Control | ||
| Tobey’96[39] | ME (Bx ≤ 5 cm). Cut-off Ø máximo 2.4 µm (SS-ESP: 73-100%) (13C,6EE,5ENE) | 1.0 ± 0.2 | 0.8 ± 0.1 | 0.5 ± 0.1* | 80 | 67 | 0 |
| Calabrese´03[76] | ME (Bx 5 cm; PL 2 sem) Cut-off Ø medio 0.74 µm (12C,11EE,17ENE) | 2.2 ± 0.5 | 2.4 ± 0.4 | 0.6 ± 0.1* | 100 | 100 | 0 |
| Caviglia´05[78] | ME (Bx 5 cm; PL 3 sem) Cut-off Ø medio 0.47 µm (7C,9ENEpH+,11PF) | pH+: 1.49 pH-: 1.45 | - | 0.45* | pH (±) 100 | - | 14 |
| Vela’11[85] | ME-morfometría (Bx 5 cm. Refractarios IBP) Cut-off Ø medio 0.68 µm (11C,15EE+ENE+EH, 11PF) | 0.87 | 0.32* (PF: 0.42) | Cut-off > 0.68 µm: 60% ERGE vs. 9% PF | |||
| Solcia’00[52] | ME+MO (Bx 2-3 cm) Cambios cualitativos (12C,22EE,44ENEpH+) | DEI: SS: 72%: ESP: 92% | 68 | 90 | 8 | ||
| Villanacci´01[84] | MO-semicuantiativo (0-3) y morfométrico (área DEI). (Bx 3 cm) (14EE,7ENE) | 272 µm2 | 278 µm2 | - | 71 | 100 | - |
| Armstrong´03[93] |
MO (Bx UGE y 2 cm) Cut-off Ø máximo 2.4 µm | - | - | - | UGE 77 2cm 41 | UGE 96 2cm 66 | - |
| Vieth´04[28] | MO 44-Pirosis + manchas rojas en endoscopia | - | - | - | Manchas rojas: 91 | 56 | |
| Bove´05[71] | MO (10C,7EE,10ENE): antes vs después de 30´ de perfusión ácida | - | - | - | 80 vs 70 | 86 vs 86 | 22 vs 44* |
| Zentilin´05[16] | MO (Bx 2-4 cm. PL 2-4 sem). Semicuantitativo (20C,48EE,59ENEpH+, 12PF) |
DEI: SS: 86%: ESP: 70’% | 83 (pH+) 67 (pH-) 80 (pH ±) | 94 | 30 | ||
| Takubo’05[35] | MO (38C,69EE,49CaE, 16Autopsias) | - | - | - | CaE 33 Autopsia 0 | 48 | 21 |
| Cui’11[79] |
MO-morfometría + ME (Bx 2-3 cm) Correlación MO y ME (r=0.60) Cut-off Ø medio 0.85 µm (SS-ESP: 93-100%) (42C,61ENE,58EE) | 1.07 ± 0.3 | 1.29 ± 0.2 | 0.58 ± 0.16* | - | - | - |
| Savarino’13[83] | MO (Bx 2 cm. PL 2-4 sem) (20C,22ENEv,20EH, 20EE,15PF) | - | - | - |
ENEv 95 EH 70 PF 33 | 95 | 25 |
2. Estudios experimentales de las DEI: hallazgos fisopatológicos del daño mucoso inducido por el reflujo
Estudios experimentales han demostrado que la exposición al ácido de la mucosa esofágica produce una elevación en la diferencia de potencial de la mucosa para, después, ir descendiendo paulatinamente hasta ser nula. Al inicio de la agresión inducida por el RGE, y mientras ésta no sea muy intensa y repetitiva, aparecerían las DEI y, posteriormente, si persiste la agresión, aparecerán las lesiones endoscópicas[36],[38]. En este sentido, las DEI serían una manifestación histológica muy inicial de la esofagitis microscópica (Em). Las células de la mucosa esofágica están unidas por un triple complejo proteico: 1) claudinas y ocludinas en las tight junctions, 2) e-cadherina en las uniones adherentes (JAM), y 3) desmogleína y desmocolina en los desmosomas[18],[48],[49]. Cuando por efecto del ácido estas uniones fallan, aparecen las DEI al separarse las membranas intercelulares. En este momento, la resistencia de la mucosa baja y aumenta la permeabilidad a los contenidos luminales por vía paracelular, más que transcelular. Para que aparezcan las DEI son precisas dos condiciones: 1) altas concentraciones de H+ que rompan la barrera epitelial y aumenten la permeabilidad paracelular, y 2) altas concentraciones de Cl- que difundan a través de esas roturas hacia los espacios intercelulares y den lugar a un gradiente osmótico que arrastre el agua hacia ellos, dilatándolos[50] (Figura 4). Las DEI no aparecen con el ácido sulfúrico, pues los iones SO4- son demasiado grandes como para penetrar en los espacios intercelulares y crear un gradiente osmótico. Un estudio[41] mostró que las DEI no están uniformemente distribuidas localizándose, preferentemente, en la parte alta del epitelio escamoso. Además, las alteraciones en los desmosomas se relacionaban con la intensidad del daño inducido por el RGE, aunque la expresión de claudinas 1 y 2 fue similar en pacientes con EE, ENE y controles. Sugieren que el daño de los desmosomas está en relación con la aparición y tamaño de las DEI. Por el contrario, en otro estudio, también investigando la distribución de varias proteínas de unión intercelular como ocludina, claudina-1, claudina-2, zonula ocludens-1 y zonula ocludens-2 en pacientes con EE y ENE, observaron solo la sobreexpresión de las dos claudinas en la EE, aunque sin correlación con la presencia y tamaño de las DEI51. Las DEI, sobre todo las apreciadas en la mitad inferior de la mucosa, también se han relacionado con la infiltración de eosinófilos y/o neutrófilos, así como con la pérdida/alteración de los glicoconjugados que sellan los espacios intercelulares. Tras el análisis inmunohistoquímico, utilizando anticuerpos monoclonales CD-15 contra esos glicoconjugados, se pudo apreciar una alteración en estas glicoproteínas con pérdida de su patrón normal laminar y compacto. Estos cambios son más evidentes en la mitad superior de la mucosa y posiblemente representan una alteración precoz de la función de la barrera mucosa, previa a la lesión mucosa, ante una agresión externa. Pueden ser focales o sutiles, por lo que pueden ser indetectables en un estudio histológico rutinario[52]. En los casos más graves, junto a la lesión mucosa, estos hallazgos se aprecian también en la capa espinosa más profunda e, incluso, en la basal. Solcia et al.[52] aseguran que la irregular y peculiar forma de los DEI hace que sean fácilmente identificables al MO, por lo que una sencilla evaluación cualitativa sería una buena alternativa a los más complejos estudios morfométricos al ME/MO[39] (Figura 5). El ácido que es inicialmente neutralizado por el bicarbonato presente en el medio, pero llega un momento en que éste es insuficiente para neutralizar la agresión, aconteciendo dos hechos: 1) Los receptores de las neuronas nociceptivas quimiosensitivas (sensibles al ácido y/o álcali) se activarían, enviando señales vía médula-cerebro, lo que se percibe centralmente como síntomas (pirosis)[53]. Los receptores de las neuronas nociceptivas, como el receptor vaniloide de potencial transitorio-subtipo 1 (TRPV-1) y canales iónicos sensibles al ácido (ASIC), están localizados en las terminaciones nerviosas sensitivas de la mucosa esofágica y responden a cambios en el pH, aunque no haya lesión[39],[54]-[58]; es decir, como es característico en la ERGE, puede haber síntomas sin lesión. 2) La acidificación del espacio intercelular expone a la membrana basolateral al ácido, dando lugar a una acidificación del citosol, cambios en la osmorregulación celular, edema y muerte celular[59],[60]. En otro estudio experimental, Tobey et al.[61] encontraron que las DEI permitían el paso de moléculas del tamaño del dextrano de 20 kD, favoreciendo la entrada del EGF salivar (6 kD) hacia la capa basal, promocionando su regeneración y reparación. Consecuencia de todo este proceso sería la aparición de un marcador microscópico de daño/reparación, como la hiperplasia de la capa basal. También se ha comprobado la presencia de DEI en pacientes adultos con esofagitis microscópica linfocítica o eosinofílica[63],[64], en niños con esofagitis esosinofílica[64], alergia alimentaria e, incluso, con el estrés; así como en estudios experimentales con exposición de la mucosa esofágica al ácido, bilis, alcohol, AAS o infección por C. albicans[65]-[67]. En el caso del estrés, por mecanismos similares a los comprobados en la piel o en el tubo digestivo bajo, con incremento de mastocitos en la submucosa[67]-[70]. También se ha comprobado la aparición de DEI en humanos sanos tras la infusión lesiva de una solución ácida pH 1[71] y se ha demostrado el papel lesivo de la bilis en el desarrollo de la EE y esófago de Barrett[72]. El clásico estudio experimental en conejos de Farré et al.[66] demostró el daño tisular precoz de la bilis, al comprobar la aparición de diversas alteraciones funcionales de la mucosa: descenso en la resistencia eléctrica transepitelial (TER), aumento de la permeabilidad y, por último, aparición de DEI, tras el contacto de la mucosa esofágica con la bilis junto a un ácido débil (pH = 4-7, similar al que presentan pacientes en tratamiento con IBP) y, en mayor cuantía, que cuando se utilizó solamente el ácido. Además, en voluntarios humanos, la aparición de las DEI tras la infusión de soluciones de diferente acidez/alcalinidad en el esófago fue muy rápida, a los 50 min (30 min de perfusión + 20 min de espera, antes de tomar las biopsias), afectando tanto a la zona infundida como a las proximales. Sin embargo, esta infusión nociva no se acompañó de síntomas por lo que, en "algunas ENE", éstos podrían originarse por causas diferentes a las DEI (¿serían las ENEf?), quizás a través de sustancias como TRPV-1, ASIC y receptores purinérgicos P2X[56],[57],[73].
Tabla 2
Reconocimiento y evaluación de las Dilataciones de los Espacios Intercelulares (DEI) mediante MO[20].
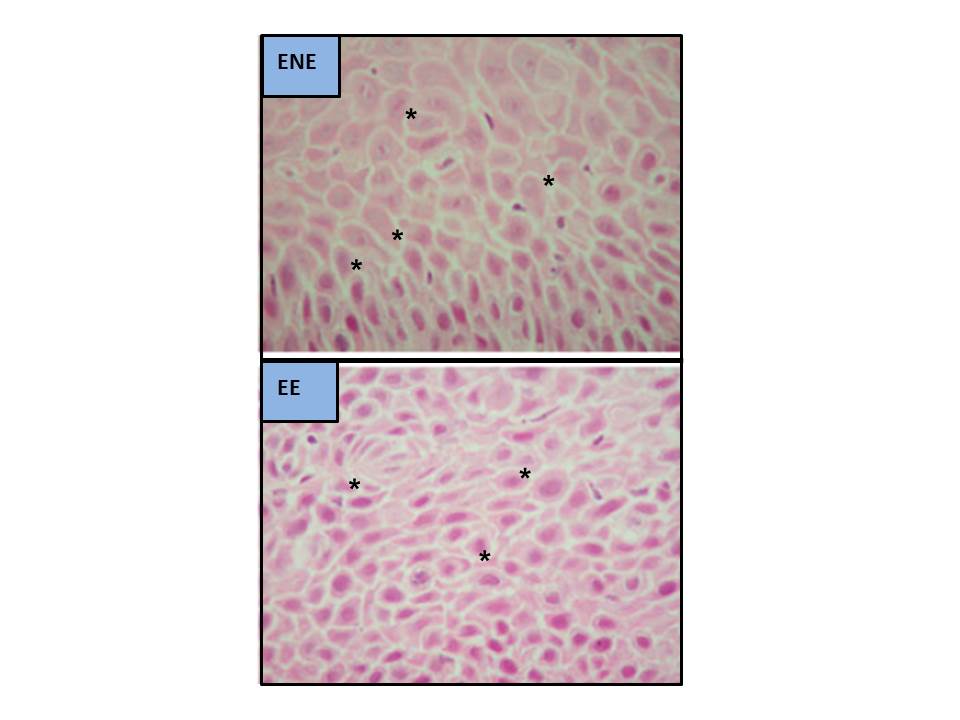
Figura 5
Dilataciones de los Espacios Intercelulares al MO (modificado de Solcia et al.[52], 2000. Tinción H&E, aumentos x350 [C y EE] y x900 [ENE]. DEI señaladas con asteriscos).
Figura 6
Dilataciones de los Espacios Intercelulares al MO (modificado de Kandulski et al.[21], 2013. Tinción H&E, aumentos x400. DEI señaladas con asteriscos).
Figura 7
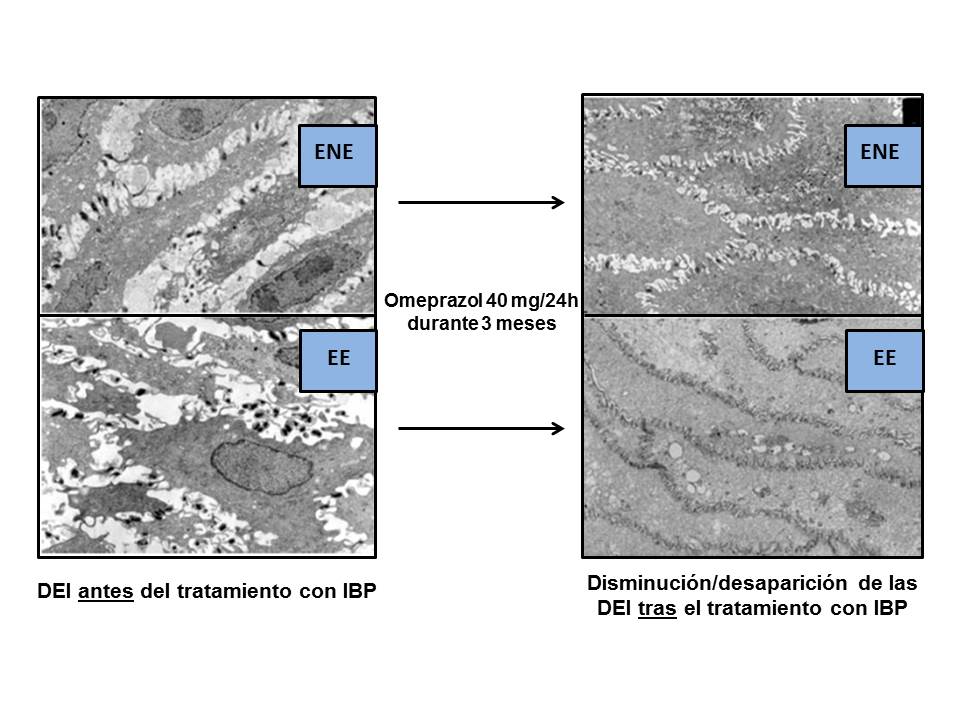
Mejoría/desaparición de las DEI al MO, en pacientes con ENE y EE, tras un tratamiento con omeprazol (40mg/24h/3meses) (modificado de Calabrese et al.[86], 2005) .
Figura 8
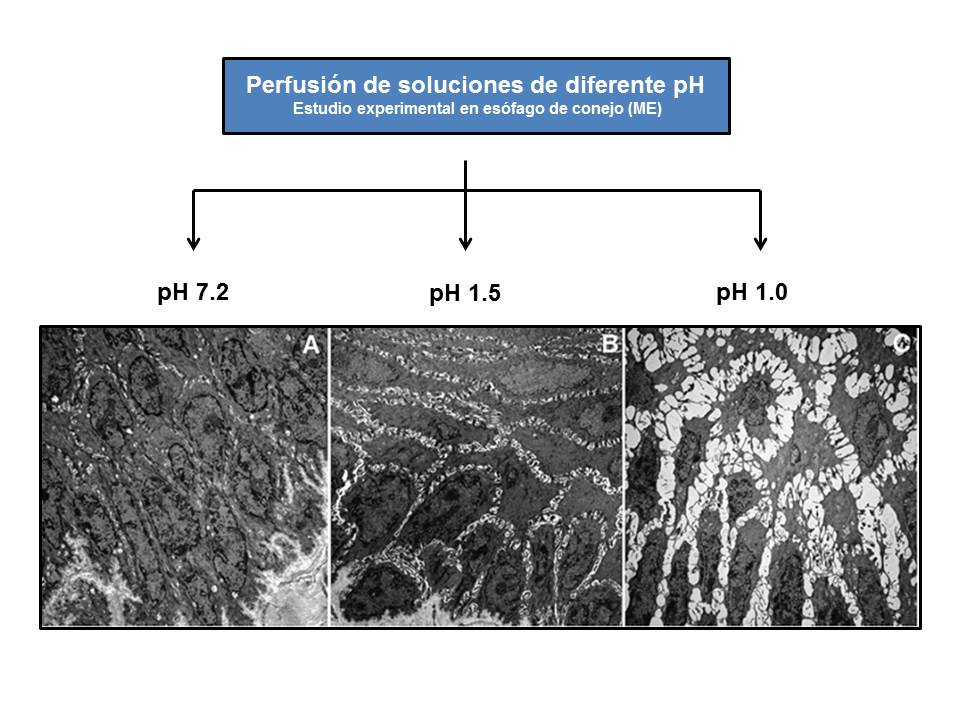
Aparición de las DEI tras el daño inducido en la mucosa esofágica por la perfusión de soluciones ácidas de diferente pH (modificado de Farré et al.[98], 2011. Estudio experimental en conejos).
3. Investigación clínica de las DEI en humanos (Tabla 1)
Primeros estudios de las DEI al Microscopio Electrónico (ME)
Unos años después del estudio de Tobey et al.[39], en el año 2000, el grupo de Enrico Solcia[52] comunicó la existencia de las DEI al ME en el 90 % de pacientes con EE, 68% de pacientes con ENE y 8% de controles asintomáticos. Aunque las DEI son más frecuentes en el esófago distal y capas más profundas, también se pueden apreciar en el proximal, siendo alteraciones estables en el tiempo[74],[75]. Las DEI tienen la gran ventaja de no precisar una correcta orientación de la muestra, presentando una mayor sensibilidad que los infiltrados inflamatorios. En 2003, Calabrese et al.[76], en un estudio al ME, confirmaron los hallazgos de Tobey et al.[39] sin encontrar diferencias entre pacientes con un RGE ácido vs. biliar (medido por Bilitec®), o aquellos con ENE vs. EE. A los pacientes se les evaluó sintomáticamente y mediante realización de EDA, pHmetría (en el clásico estudio de Tobey et al.[39] no se hizo pHmetría) e histología. La importancia de realizar una pHmetría al grupo control, se justificó por la exclusión de 2 sujetos asintomáticos, inicialmente parte del grupo control, que mostraron una pHmetría patológica y DEI. Afirman que el mejor parámetro para la evaluación de las DEI era el valor de su diámetro medio (Ø), mejor que el diámetro máximo, siendo el cut-off de Ø entre controles vs. pacientes de 0.74 µm (vs. 2.4 µm de diámetro máximo, según Tobey et al.[39]). Todos los controles tenían un Ø significativamente menor que los pacientes con ERGE (< 1.69 µm vs. 9.36 µm). En ese mismo año, Vieth et al.[77] mostraron la importancia de tomar las biopsias en el lugar adecuado. Así, apreciaron DEI al MO en ENE y EE, en el 77% y 96% en muestras tomadas en la unión gastroesofágica y 41% y 66% en muestras tomadas a 2 cm de ésta, respectivamente. Recomiendan que, si en la mucosa esofágica se encuentran manchas rojas, precursoras de las erosiones, las biopsias se deben de tomar en ellas, pues las DEI se detectaron allí en el 90.5% vs. 56.1% en las áreas macroscópicamente normales. Concluyen que la evaluación de las DEI sea incorporada a la rutina del estudio histológico de la mucosa esofágica en relación a los daños inducidos por el RGE. Posteriormente, en 2005, Caviglia et al.78 observaron al ME que el Ø de las DEI en ENE, tanto con pHmetría patológica como normal, era 3 veces mayor que en los controles: 1.49 µm, si la pHmetría era patológica y 1.45 µm, si la pHmetría era normal vs. 0.45 µm en los controles (p<0.001), de forma similar a lo apreciado con la media de los diámetros máximos (3.78 µm vs. 1.6 µm; p<0.001), y sin diferencias entre ENE con pHmetría patológica y normal. Consideran las DEI como una alteración característica de la ENE, un marcador de los síntomas de la ERGE y expresión de un descenso en la resistencia de la mucosa, con independencia del resultado de la pHmetría.
Estudio de las DEI al Microscopio Óptico (MO). Diagnóstico de Esofagitis microscópica (Em)
Tras el primero comunicado de Solcia[52][52] en el año 2000, el grupo de Zentilin et al.[16] volvió a dar protagonismo a la MO, realzando el valor diagnóstico de las clásicas lesiones elementales inducidas por el RGE, a las que añadieron la evaluación de las DEI. Desarrollaron un sistema de puntuación global sobre biopsias tomadas, en la línea en "Z", 2 y 4 cm. más proximales, en 135 pacientes con síntomas atípicos y atípicos de ERGE. Las 6 lesiones elementales analizadas fueron: hiperplasia de la capa basal, elongación de las papilas, DEI, infiltrado intraepitelial de eosinófilos y neutrófilos y presencia de necrosis/erosión; que evaluaron en 20 controles, 48 EE, 59 ENEv y 12 ENEf (EH+PF). Concluyen que los estudios histológicos al MO son un buen procedimiento para detectar la existencia de ERGE, ya que se apreció una esofagitis microscópica (Em) en el 84% de ERGE vs. 15% de controles (p< 0.00001), con una significativa correlación entre la puntuación global histológica y el porcentaje de tiempo con pH<4 (r = 0.43, p<0.001); indicando que la Em era principalmente debida al RGE. La sensibilidad para el diagnóstico de ERGE fue 84%, comparable a los estudios clásicos de Ismail-Beigi et al.[19] y Behar et al.[30], con una especificidad del 85% (en otros estudios, la especificidad del diagnóstico de ERGE con datos obtenidos al MO osciló entre 27-78%)[31],[32]. Comunicaron que, en las ENE totales, las DEI tenían un valor diagnóstico similar al de la hiperplasia de la capa basal (se encontraron en el 83% y 92%, respectivamente). La sensibilidad en el conjunto de las lesiones histológicas evaluadas fue del 96% en EE, 80% en ENEv, 58% en ENEf (76% en ENE total) vs. 30% en controles. Cabe supone que, en los pocos casos de PF (EDA normal y pHmetría normal) con lesiones histológicas, los síntomas podrían provenir de un reflujo débilmente ácido, no ácido o alcalino. Este grupo también afirma que es más rentable el uso de la histología que la práctica de una pHmetría, lastrada con un número poco aceptable de falsos negativos en la EE[8],[10]-[12]. En 2009, el mismo grupo obtuvo similares resultados y conclusiones en otro estudio al MO[24], comprobando que la existencia de DEI presentaba una sensibilidad-especificidad del 80%-70%. La frecuencia de estas lesiones fue del 94% en EE, 83% en ENEv, 67% en ENEf y 30% en los controles[16]. Este grupo recomienda que la toma de las muestras de biopsia sea en la línea en "Z" o en los 2 cm. más proximales a ésta, ya que la frecuencia de todas las lesiones elementales evaluadas disminuye proximalmente. Sin embargo, se debe de dar una explicación al elevado porcentaje (¡30%!) de DEI en controles. La selección de un grupo control obliga a que estrictamente sea un sujeto asintomático en el momento del estudio y en un tiempo previo, que no haya tomado IBP en las 4-6 semanas previas, la EDA sea normal (Los Ángeles: N ó A), pHmetría normal y Em (-). Estos criterios no se cumplen casi nunca y en casi ningún estudio, lo que hace difícilmente comparables sus resultados. ¿Qué significado tiene que el grupo control tenga DEI en un 30%?. Está comprobado que existe un RGE fisiológico, que podría producir alteraciones histológica leves, sobre todo en la línea en "Z" o pocos cm. más proximalmente; es decir, se podría admitir que un control tuviera lesiones histológicas leves (¿Los Ángeles M ó A?) y solo en la parte más distal del esófago (¿≤ 2 cm.?). Los criterios que debe de cumplir un sujeto control para los estudios relacionados con la ERGE pueden ser más o menos estrictos, pero, hoy en día, es un tema de debate aun no resuelto, aunque no exento de interés. En un reciente y excelente estudio, con MO-morfométrica y ME, del grupo chino de Cui et al.[79] comprobaron la validez diagnóstica de las DEI en la ERGE, con una buena consistencia Kappa (k = 0.691) y correlación (r = 0.605) entre las medidas obtenidas mediante MO y ME, con valores de Ø al MO significativamente mayores en 58 pacientes con EE y 61 con ENE vs. 42 controles. El cut-off para los valores de Ø de DEI, que diferenciaban ENE de controles, fue de 0.85 µm (sensibilidad del 93%, especificidad del 100%) (Tabla 1). Frente a las evidentes ventajas de los estudios al MO vs. ME, los primeros tienen una limitación en la resolución, solo son visibles las DEI ≥ 0.2 µm, por lo que éste sería el mínimo tamaño de DEI cuantificable con el MO[79]. Son pocos los estudios que se han comunicado en relación a la presencia de DEI en niños con síntomas sugerentes de ERGE o esofagitis eosinofílica[64]. El primer estudio fue el de Ravelli et al.[80] en el año 2006, realizado con MO en 48 niños con EE. Sus resultados fueron similares a los obtenidos posteriormente, en 2012, por el grupo de Mancini et al. [81], quienes evaluaron la presencia de DEI mediante ME en 20 niños con EE y 24 con ENE vs. 10 controles asintomáticos. Comprobaron que el tamaño de las DEI era significativamente mayor en los casos de EE y ENE vs. controles (valores de Ø ± DS: 1 ± 0.2 mµ y 0.9 ± 0.2 mµ vs. 0.5 ± 0.2 mµ), aunque sin relación entre el diámetro de las DEI y los diversos parámetros evaluados en la pHmetría, ni con su consideración de patológica o normal. Concluyen que, en niños, las DEI son también un marcador precoz y sensible de daño mucoso inducido por el RGE, sin poder diferenciar los dos fenotipos de ERGE, ni relacionarse con los resultados de la pHmetría. En 2014, el mismo grupo dirigido por Borreli et al. [82] estudió niños con tos crónica (15 pacientes vs. 12 controles), sugerente de ser causada por el RGE, mediante pHmetría y una evaluación de las DEI con ME. Señalan la importancia de la cuantificación de las DEI en estos casos, como expresión de la lesión mucosa inducida por el ácido, aunque su presencia y diámetro tampoco se relacionaron con ninguno de los parámetros de la pHmetría, ya fuera patológica o normal.
4. Metodología para cuantificar la presencia de las DEI
De forma aproximada, ≥ 2/3 de los pacientes con ENE tienen alteraciones histológicas compatibles con Em, una de las cuales son las DEI[83]. Diversos estudios, ya sea al MO o ME, han evaluado la cuantificación de las DEI, con el fin de discriminar mejor los valores entre los diferentes fenotipos de ERGE y los controles asintomáticos. Así, Solcia et al.[52]intentaron hacer una cuantificación (presencia/ausencia) de las DEI utilizando cortes ultrafinos (0.5-1 µm), pero sus resultados fueron poco concluyentes (DEI: 72% de los pacientes vs. 8% controles. Sensibilidad 72%, especificidad 92%), siéndoles imposible distinguir casos con esofagitis leve y controles. Otros estudios también han intentado cuantificar las DEI mediante procedimientos cuantitativos, semicuantitativos e, incluso, morfométricos y automatizados, tanto en biopsias proximales como distales (2, 5 y 10 cm. más proximales desde la línea en "Z"). En realidad, los estudios al ME se conforman con el ímprobo trabajo de realizar múltiples medidas (10 medidas x foto, en 10 fotos = 100 medidas por paciente) y utilizar el parámetro del diámetro medio (Ø) como valor de comparación. Lo engorroso de este procedimiento explica el escaso número de pacientes incluidos en los estudios de las DEI al ME. Sin embargo, son los estudios al MO los que han hecho una aproximación más práctica, aunque no exenta de complejidad, a la cuantificación los DEI[12],[16],[67],[76],[84]. Un ejemplo sería el sofisticado método desarrollado recientemente en el estudio EcoHisto Proyect[20],[22], que propone un detallado proceso para cuantificar los DEI, a las que define como dilataciones redondeadas e irregulares, o ensanchamiento difuso del espacio intercelular (a x40 aumentos). Inicialmente las cuantificó como 0= ausentes, 1= pequeñas y 2= grandes o muy grandes para, posteriormente, redefinirlas de una forma más detallada, pero también más compleja (Tabla 2). La práctica clínica impone utilizar su primer intento. Casi todos los estudios concluyen en la superioridad de los estudios con ME en la valoración de las DEI, procedimiento que consideran es el "patrón oro", al no apreciarse solapamientos entre los datos de los pacientes y los del grupo control. En todo caso, son preferibles los resultados obtenidos con las pruebas cuantitivas (sensibilidad del 86%) vs. semicuantitativas (con una menor especificidad). Sin embargo, también reconocen que los estudios al ME son muy exclusivos, caros y consumen mucho tiempo, lo que les hace poco o nada útiles para la práctica clínica.
5. Utilidad de la DEI en en el diagnóstico de la Pirosis Funcional
La distinción entre EE y ENE es sencilla tras la práctica de una EDA, pero no así entre una ENEv y una ENEf (EH y PF, trastornos funcionales del esófago, según criterios de Roma IV[7]), ya que para su diagnóstico se precisa de la práctica de una pHmetría y valoración síntomas/episodios de RGE mediante SAP/SI. Este es el punto en donde está "bloqueado" el procedimiento diagnóstico de la ERGE. ¿Qué hacer tras la realización de una EDA?: 1) una pHmetría con los inconvenientes ya referidos ó 2) un más accesible y menos costoso estudio histológicos, aún con la falta de especificidad de las lesiones elementales comentadas o la dificultad en el estudio de algunas de ellas (correcta orientación). Es preciso separar la ENEv cuyo tratamiento es básicamente antisecretor, de las ENEf en donde podrían ser necesarios fármacos neuromoduladores o neurolépticos, asociados o no a IBP (sobre todo en EH). Vela et al.[85] estudiaron al ME, en pacientes refractarios a IBP, la diferencia en el tamaño de las DEI en EE + ENE (ENEv + EH, n=15), PF (n=11) y 11 controles, apreciándose diferencias significativas entre sus valores respectivos (0.87 µm vs. 0.42 µm vs. 0.32 µm); mostrando DEI el 60% de EE + ENE vs. 9% de los controles (p<0.01). El límite superior del valor normal de DEI en controles (95% de percentil) fue 0.68 µm (cut-off); siendo los valores de los controles y PF similares (p=ns). En otros estudios el valor Ø medio de las DEI en controles osciló entre 0.47 µm y 0.85 µm[76],[78],[79]y el valor del diámetro medio máximo fue ≤ 2.4 µm[39] (Tabla 1). Por todo ello, afirman que estos valores de las DEI podrían servir para diferenciar los pacientes con ENE refractarios a los IBP de aquellos con PF (pacientes refractarios a los IBP son aquellos que obtienen un alivio sintomático parcial y < 50%, tras 6 semanas de tratamiento con doble dosis de IBP)[85],[87]. Hasta un 40% de los pacientes con síntomas de ERGE tratados con IBP tiene una respuesta negativa, lo que puede ser debido a una insuficiente inhibición, a la presencia de un EH (síntomas, aún con pH altos tras inhibición con IBP) o de una PF. En este sentido, Kandulski et al.[21] intentaron analizar al MO las diferencias histológicas entre pacientes con ENE (10 ENEv + 10 EH), EE (n=23) y PF (n=19), todos ellos refractarios a IBP, mediante una evaluación semicuantitativa de tres lesiones (DEI, elongación de papilas e hiperplasia de la capa basal) y comparación de sus datos vs. 25 controles (Figura 6). No se apreciaron diferencias entre grupos en lo referente a los síntomas evaluados según el cuestionario RDG, pero si existieron entre ha puntuación histológica global y los valores de las DEI de pacientes con ENE (ya sea considerados globalmente ENEv + EH o de forma individual) vs. PF y controles (p<0.0001). El valor de las DEI en la PF fue de 0.75 µm vs. 1.75 µm en las ENE (controles 0.72 µm). Los valores respectivos de la puntuación histológica global fueron 3.8, 6.3 y 3.3 (p<0.0001). Además, encontraron una débil correlación entre la presencia de DEI y el tiempo de exposición ácida (% del tiempo con pH<4) o número de episodios de reflujo ácido o gaseoso; concluyendo que el estudio histológico es capaz de diferenciar la ENE de la PF en pacientes refractarios a IBP. El estudio de la curva ROC mostró un cut-off ≥ 5 para la puntuación histológica global que diferencia las ENE de la PF (sensibilidad-especificidad de 83%-64%). Un estudio similar, también demostró la validez del estudio histológico en la diferenciación entre ENE y PF[83], tanto en la puntuación individualizada de cada una de las lesiones elementales evaluadas, como en la puntuación global. Consideraron que una puntuación histológica global ≥ 0.35 era diagnóstica de Em, apreciándola en el 95% de EE, 77% de ENE, 65% de EH vs. 13% de PF y 15% de controles (p<0.0001). Dada la escasa frecuencia con que se presenta la Em en los pacientes con PF (similar a los controles) se podría afirmar, con una elevada probabilidad, que ese sería el diagnóstico de los pacientes con síntomas de ERGE, pHmetría normal y sin Em. La presencia de DEI en esos grupos fue 95%, 95%, 70%, 33%, 25%, respectivamente (p<0.0001). Concluyen que la buena sensibilidad del estudio histológico en el diagnóstico de ERGE (81%) y ENE (74%), junto a su alta especificidad en la PF (87%) y controles (85%), demuestran su validez como método diagnóstico en la ERGE.
6. Relación entre los Síntomas de ERGE y las DEI
Algunos estudios han encontrado una correlación entre la presencia de las DEI y los síntomas de ERGE como la pirosis[74],[78],[88], con independencia del resultado de la pHmetría[78]; habiéndose comprobado la mejoría de las DEI y los síntomas tras un tratamiento con IBP[76],[88]. Sin embargo, algunos pacientes con DEI siguen presentando síntomas de RGE tras inhibir el ácido con IBP, lo cual podría estar en relación con un RGE débilmente ácido o alcalino (¿EH?), más o menos persistente89. El estudio de Tadiparthi et al.[90] mostró que la EE y la ENE no eran diferentes en cuanto a la evaluación de los síntomas (con cuestionarios GER-Q y RDQ) o la presencia de lesiones histológicas. Sin embargo, aunque existió una relación significativa entre las puntuaciones sintomáticas y la histológica (en concreto, presencia de DEI e infiltrado linfocitario), ello solo se apreció en el grupo de EE. Por todo ello, debemos admitir que los síntomas de algunas ENE pueden originarse por otras causas diferentes a las DEI quizás, como ya se comentó, por la acción de sustancias como TRPV-1, ASIC y receptores purinérgicos P2X[56],[57],[67],[73].
7. Regresión de las DEI tras tratamiento antisecretor
Hay estudios que han demostrado que el tratamiento con IBP puede restaurar los DEI a su valor normal en > 70% de los pacientes[77],[86],[91],[92], de forma equivalente a la cirugía antirreflujo[33]. Al MO, se ha comprobado que tres lesiones elementales evaluadas (hiperplasia de la capa basal, elongación de las papilas y DEI), mejoraron/normalizaron tras tratamiento antisecretor, en especial las DEI. Así, el estudio de Armstrong et al.[93], utilizando esomeprazol (40mg/d/4sem) o ranitidina (300mg/d/4sem), mostró una mejoría/normalización de las DEI, pasando desde el 76% al 53% y del 80% al 69% de los pacientes, respectivamente. El grupo de Calabrese et al[86], en un estudio al ME, trató 22 ENE y 16 EE con omeprazol (40mg/d/3meses) apreciando una desaparición de las DIS y los síntomas en el 92% de los 38 casos. Tras otros 3 meses de tratamiento, en los 3 pacientes sin respuesta, consiguieron normalizar síntomas y DEI en 2 de ellos (97.4% de regresión a los 6 meses de tratamiento), comprobando el paralelismo entre síntomas y DEI (Figura 7). A los 3 meses de tratamiento, los Ø de las DEI pasaron de 2.04 µm a 0.54 µm en ENE y de 1.95 µm a 0.65 µm en EE, tanto en pacientes con RGE ácido como alcalino, todos ellos con pH-MII (+). El cut-off de DEI patológico fue ≥ 0.74 µm. Otros estudios no consiguieron esas elevadas frecuencias de reversibilidad de las lesiones/síntomas con IBP, llegando solo a < 30%; lo cual podría ser debido al escaso tiempo de tratamiento (4 sem. vs. 3 meses)[86],[94]-[96]. Incluso, un reciente estudio confirma que los pacientes con ENE refractarios a IBP mantienen las DEI[89], lo que obligaría a suponer que el causante de las DEI y/o síntomas no fuera el ácido y si otras sustancias refluidas (bilis y componentes del jugo pancreático)[66],[67]. Lógicamente, en estos casos sería obligatoria la práctica de la doble exploración, pH-MII. Por otra parte, es necesario mencionar que en algunos estudios no fue posible la práctica de la MII al ser aprobada por la FDA en 2002 usándose, en su lugar, el detector alcalino llamado Bilitec®. En el estudio de Ravelli et al.64, se evaluó la presencia de DEI al ME y MO en 22 niños con esofagitis esosinofílica refractaria a IBP (4-6 sem.) clínica e histológicamente vs. 30 controles, así como su mejoría tras un tratamiento con corticoides y/o dietas de exclusión. Los valores de Ø de DEI en los pacientes fueron 2.26 ± 0.21 mµ (MO y morfometría) y 2.24 ± 0.28 mµ (ME) vs. 0.62 ± 0.08 mµ y 0.33 ± 0.24 mµ, de los controles. Tras el tratamiento, los valores de DEI descendieron a 1.23 ± 0.20 mµ (MO y morfometría) y 0.98 ± 0.19 mµ (ME), lo que afirma que la eficacia del tratamiento está en relación con la disminución del daño mucoso y de las DEI. En este punto, como complemento a la mejoría/resolución de las DEI tras tratamiento con IBP, es interesante señalar el resultado de un estudio experimental del grupo de Farré et al.97 quienes comprobaron el papel "preventivo/protector", respecto a la aparición de las DEI, de sustancias antioxidantes (NAC y Vitamina C). Aunque, como se ha comentado, se ha sugerido una relación entre presencia de DEI y el síntoma pirosis, ello no está claramente demostrado, sugiriéndose posibles mecanismos fisiopatológicos que la explicarían[12],[74],[78],[88]. De demostrarse esta relación, se podría considerar a las DEI como un marcador de la ENE. Ello se basa en las siguientes razones: 1) se han encontrado en pacientes con ENE (EDA normal y pHmetría patológica), 2) se normalizan tras tratamiento con IBP, al tiempo que desaparecen los síntomas como la pirosis, y 3) se pueden inducir en controles sanos asintomáticos tras la infusión esofágica de ácido.
8. La Impedanciometría, un método para evaluar la función de la mucosa esofágica. Protagonismo de las DEI
La evaluación de la conductividad eléctrica de la mucosa esofágica es un parámetro íntimamente relacionado con su buena funcionalidad. El grupo de Farré et al.[66] demostró en estudios experimentales y en humanos que la caída de la impedancia basal de la mucosa esofágica está en relación con la de la TER y el daño de la mucosa esofágica inducido por el RGE ácido, débilmente ácido o alcalino, tanto en EE como en ENE[98],[99]. La infusión de soluciones pH 1.0 y 1.5 indujeron caídas de la impedancia mucosa basal paralelas a las de la TER y aparición de las DEI[100], concluyendo que, en pacientes con ERGE, la utilización de estos métodos pueden ser útiles en el estudio del daño de la mucosa inducida por el RGE (figura 8). El grupo chino de Zhou et al.[101] evaluó en 352 pacientes, la sensibilidad y especificidad de 5 pruebas habituales en el diagnóstico de ERGE: cuestionario GERD-Q (58% y 49%), impedanciometría (66% y 43%), pH-MII (94% y 43%), DEI > 0.9 mµ (61% y 56%) y prueba de respuesta a IBP (71% y 44%). Sin embargo, ninguna de ellas fue suficiente para un diagnóstico individualizado. En otro estudio sobre 20 pacientes con ENE y 30 con PF se comprobó que los pacientes con ENE tenían más baja impedancia basal vs. PF, una recuperación más lenta de la misma tras infusión de ácido (pH 1, durante 10 min.), posiblemente por los repetidos episodios de RGE en los ENE vs. PF, y una mayor sensibilidad al ácido (¿EH?), quizás por hacerse la mucosa más vulnerable a la percepción de los síntomas durante el prolongado período de recuperación de los valores basales[102]-[104]. La acidificación del esófago puede inducir a la degranulación de los mastocitos, activación de las neuronas aferentes sensibles a la capsaicina y liberación de neurokinas. Se ha sugerido que estos mediadores podrían ser los responsables, tras episodios de acidificación, de la aparición de las DEI y de la hipersensibilidad demostrada en algunas ENE (¿EH?)[105]. Otro grupo chino, encabezado por Zhong[106] estudió la impedancia basal de la mucosa esofágica como medida del daño inducido tras la infusión de ácido en 229 pacientes con ERGE y 34 controles. Realizaron pH-MII, EDA, cuestionario GERD-Q, medida de las DEI (MO y ME) y expresión de proteínas de las tight junctions (claudina 1 y 3 y ocludina). Apreciaron que la impedancia basal en EE (1752 ± 1018 Ω) y ENE (2640 ± 1143 Ω) eran significativamente inferiores a la del grupo control (3360 ± 1258 Ω); siendo el cut-off que diferenciaba pacientes con ERGE y controles: 2167 Ω (sensibilidad 94%, especificidad 51%). También apreciaron una significativa mayor caída de la impedancia mucosa en los ENE vs. controles (3360 ± 1258 Ω), tras ser infundidos con soluciones ácidas (2510 ± 1239 Ω), débilmente ácida (2801 ± 1156 Ω) y mezcla ácida/débilmente ácida (2393 ± 1009 Ω). Las soluciones débilmente básicas afectan poco la impedancia, como ya comprobó Farré et al.[66]. También hubo diferencias significativas en la impedancia basal registrada entre los grados de EE (esofagitis C y D: 970 ± 505 Ω y esofagitis A y B: 1921 ± 1024 Ω). La impedancia basal fue significativamente menor en los cuestionarios GERD-Q positivos (≥ 8 puntos) que en los negativos (< 8 puntos) (2200 ± 1153 Ω vs. 2709 ± 1244 Ω). En este sentido, también, se ha comunicado que la puntuación del cuestionario GERD-Q se relacionaba positivamente con los episodios ácidos medidos mediante pH-MII[107],,[108]. Existió una correlación negativa entre la impedancia basal y el tiempo de exposición al ácido (r = -0.41, p<0.001), niveles de claudina-1 (r = -0.65, p<0.001), pero no con los de claudina-3 u ocludinas, y el tamaño de las DEI (r = -0.64, p>0.001); encontrándose mayores DEI en EE vs. ENE y controles: 1.29 mµ vs. 1.10 mµ y 1.01 mµ, respectivamente. Las tres proteínas analizadas participan en la formación de canales iónicos paracelulares y selección de iones, modulando así la conductancia paracelular y relacionándose con cambios en la TER y DEI[109]. Tanto en humanos como en animales de experimentación, ya se había comprobado la relación entre DEI y TER (correlación negativa), impedancia y TER (correlación positiva)[98],[109], e impedancia y tiempo de exposición ácida (correlación negativa)[110] pero, en humanos, este estudio es el primero en demostrar la relación – inversa - entre las DEI e impedancia basal[106]. Por todo ello, la impedanciometría y la medición de las DEI podrían ser muy útiles en el diagnóstico clínico de ERGE sin lesiones o poco sintomáticas, campo en donde son poco útiles la EDA y la pH-MII. En otro estudio sobre la impedancia de la mucosa esofágica, Kandulski et al.[111] evaluaron la impedancia y la presencia de DEI en 19 EE, 16 ENE y 17 PF. Concluyen que la medida de la impedancia es un marcador de disfunción mucosa y de su integridad, ya que diferencia a los pacientes con ERGE (EE y ENE), con una mayor caída de la impedancia, de aquellos con PF. Además, los valores de impedancia estaban inversamente relacionados con tiempo de exposición ácida (r = -0.45, p<0.008), siendo el cut-off de 2100 Ω el que diferenciaba la ERGE de la PF (sensibilidad de 78%, especificidad de 71%), y con el tamaño de las DEI (r = -0.28, p<0.06). La impedancia basal es un marcador de integridad mucosa y su determinación puede ser útil en la evaluación de los pacientes con ERGE, en especial los refractarios a IBP (la mayoría de PF con impedancia basal normal). Con los dispositivos actuales se puede medir la impedancia de la mucosa esofágica en el mismo acto endoscópico[112]. Si la medición se toma a 2 cm. de la línea en "Z", un valor de impedancia > 2970 Ω excluye la ERGE (sensibilidad 96%, especificidad 88%)112. En un reciente intento para afinar aún más el diagnóstico histológico de Em, Kataria et al.[113]realizaron una revisión y meta-análisis entre 2.871 estudios, de los cuales seleccionaron 10 (8 con grupo control) que cumplían sus criterios de inclusión, con el fin de determinar las lesiones elementales más sensibles para el diagnóstico de Em en pacientes con ENE (histología, EDA, pHmetría normal y sin consumo de IBP; por lo tanto, incluye pacientes con EH). Las lesiones evaluadas fueron hiperplasia de la capa basal, elongación de papilas, DEI y número de Eosinófilos (Eo), tomándose la muestra de biopsia a dos niveles: < de 3 cm. y ≥ 3 cm. de la unión escamoso-columnar. En las muestras más distales (< 3 cm) las mejores sensibilidades fueron para los Eo (91%), DEI (88%) e hiperplasia de la capa basal (85%). En las biopsias tomadas a ≥ 3 cm. la mayor sensibilidad fue para la elongación de las papilas (84%) y Eo (77%). Este estudio demuestra que el análisis conjunto de DEI y Eo en las biopsias de esófago es muy sensible para el diagnóstico de Em.
9. Nuevos procedimientos para detectar las DEI
Las nuevas técnicas endoscópicas como la endoscopia de alta resolución[96],[114]-[116], cromoendoscopia virtual ± lugol (i-Scan y FICE, Fuji Intelligent Color Enhancement), endomicroscopía confocal con láser[95],[117]-[122] o imagen con banda estrecha (NBI, Norrow Band Imaging) con magnificación[116],[123] han logrado visualizar alteraciones en el tejido y vasos del mucosa del esófago de forma más precisa que la endoscopia convencional, ayudando a una mejor graduación de clasificación de Los Ángeles, distinguiendo mejor las EE de las ENE. Un estudio encontró útil el uso de i-Scan + cromoendoscopia con lugol en la detección de lesiones mínimas de la ERGE (microrroturas mucosas y manchas rojas)[118]-[121], y en otro el FICE diferenció los grados N (normal) y M (lesiones mínimas: eritema sin demarcación nítida, turbidez blanquecina e invisibilidad secundaria de los vasos) en pacientes con ENE[119]-[122]. También ha sido útil el uso de la endomicroscopía confocal con láser[120],[121], apreciándose en los pacientes con ENE vs. controles un mayor número de bucles capilares interpapilares (8.3 vs. 5.6, p<0.01. Cut-off > 6 por imagen, con sensibilidad-especificidad 68%-72%), de mayor diámetro (19.5 vs. 15.9 µm, p<0.04. Cut-off > 17.2 µm, con sensibilidad-especificidad 81%-76%) y mayor Ø en las DEI (3.4 vs. 1.9, p<0.04. Cut-off > 2.4 µm, con sensibilidad-especificidad 86%-91%), correlacionando con los valores de DEI encontrados al ME (r = 0.75. p< 0.01). Si se combinaban los hallazgos primero y tercero la especificidad fue del 100%[121].
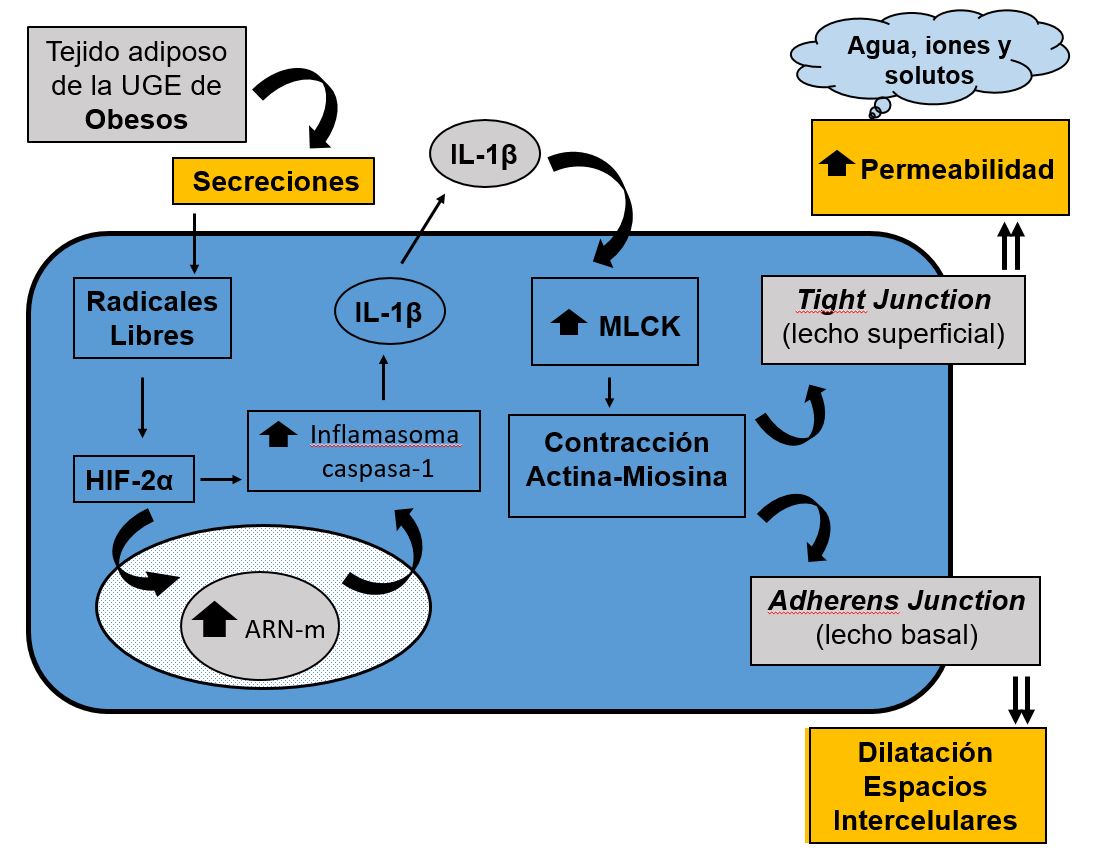
Recientemente se ha propuesto un nuevo mecanismo fisiopatológico en la formación de las Dilataciones de los Espacios Intercelulares[126]. El tejido adiposo de la UGE de pacientes obesos, con o sin ERGE, segrega sustancias que inducen la producción de radicales libres, los cuales activan la HIF-2α que, de una forma directa o indirecta, tras entrar en el núcleo de las células de tejido escamoso esofágico y regular genes asociados a la respuesta inmune innata, aumenta el inflamasoma caspasa-1 y, consecuentemente, la producción de IL-1β. Esta interleukina pro-inflamatoria aumenta la actividad enzimática de la MLCK, transformando la MLC en MLCp. Esta MLCp produce la contracción del citoesqueleto a través de la actividad actina-miosina lo que, a nivel de las células superficiales del epitelio escamoso, disminuye la función de la barrera mucosa, con un aumento de la permeabilidad y entrada de solutos, iones y agua hacia el espacio intercelular. Por el contario, la contracción del citoesqueleto a nivel de la capa basal del epitelio escamoso, en donde no hay tight juntions sino adherens junction, da lugar a las dilataciones de los espacios intercelulares (Figura 9).
Figura 9
Nuevo mecanismo fisiopatológico propuesto para la formación de las Dilataciones de los Espacios Intercelulares. (UGE= unión gastro-ésofágica; HIF-2α = factor 2α inducible por hipoxia; MLCK = quinasa de la cadena ligera de la miosina; MLC = cadena ligera de la miosina; MLCp = cadena ligera de la miosina fosforilada). (modificado de: Paris S et al[126]).
Conclusiones
Las DEI son alteraciones reales y marcadores biológicos de ERGE: No proceden de manipulaciones de la biopsia y constituyen el marcador biológico más reciente de la enfermedad mientras otros marcadores se validan.
Relación con el daño mucoso: Las DEI están directamente relacionadas con el daño de la mucosa esofágica y aparecen junto con la caída de la impedancia, el descenso de la TER y la mayor permeabilidad mucosa. Se observan tanto con reflujo ácido como con reflujo alcalino biliar o pancreático y no se correlacionan con el resultado de la pHmetría.
Frecuencia, distribución y aparición temprana: Las DEI son frecuentes e inespecíficas en la esofagitis no erosiva y se distribuyen preferentemente en los cinco centímetros distales del esófago. Aparecen muy pronto tras la agresión química, y su cuantificación más allá de presencia o ausencia resulta compleja y consume tiempo, sobre todo en microscopía electrónica. Su principal ventaja es que no requieren una orientación precisa de la biopsia.
Valor diagnóstico y comparación con otras pruebas: En humanos, la determinación de DEI muestra sensibilidad y especificidad comparables a la pH-MII y es técnicamente más sencilla. En revisiones estrictas, las DEI aparecen con mucha mayor frecuencia en pacientes con esofagitis no erosiva que en controles. Con frecuencia aparecen también en controles asintomáticos, lo que puede deberse a selección de controles no estricta.
Medidas y límites de observación: Los diámetros promedio de las DEI al microscopio electrónico y su prevalencia al microscopio óptico varían entre controles y fenotipos de enfermedad. El límite de observación al microscopio óptico se sitúa por debajo de 0.2 micras.
Utilidad clínica para el diagnóstico diferencial: La evaluación de las DEI ayuda a diferenciar EE, ENEv y EH de la PF (que se comporta como los controles), y permite distinguir la esofagitis no erosiva refractaria a IBP.
Relación con los síntomas y respuesta al tratamiento. La relación entre DEI y los síntomas de ERGE no está clara. Las DEI disminuyen o desaparecen tras tratamiento con IBP.

 Descargar número completo
Descargar número completo Download full issue
Download full issue