CITA ESTE TRABAJO
Mendoza Rodríguez R, Fernández Cano MC, Carrero Castaño A. Olmesartán como causa infrecuente de enteropatía. RAPD 2024;47(4):165-169. DOI: 10.37352/2024474.3
Introducción
La diarrea es una de las reacciones adversas medicamentosas más frecuentes. Una de las principales causas de diarrea crónica es la enfermedad celíaca; asimismo, ésta supone la principal causa de atrofia vellositaria de intestino delgado. No obstante, y de forma mucho menos frecuente, existen otras enteropatías no celíacas que conforman un grupo heterogéneo, extenso y caracterizado por diarrea y malabsorción[1],[2]. El origen medicamentoso de la diarrea es una causa no desdeñable de la misma que debemos considerar en el diagnóstico diferencial.
Los antagonistas de los receptores de angiotensina II son un grupo de fármacos ampliamente utilizado en el tratamiento de la hipertensión arterial, nefropatía diabética e insuficiencia cardíaca. El Olmesartán (como uno de sus principales representantes) es una causa infrecuente de enteropatía y que debe ser considerado en el estudio de un paciente con diarrea grave y pérdida de peso. A continuación, se expone un caso clínico que ilustra esta asociación.
Caso clínico
Mujer de 62 años con hipertensión arterial, dislipemia y enfermedad renal crónica grado 3A que se encontraba en tratamiento crónico con Olmesartán 40 mg desde hace cinco años junto con Pantoprazol 20 mg y Diltiazem 120 mg. Comenzó con diarrea de 15-20 deposiciones al día de tres meses de evolución junto con pérdida de 12 Kg de peso y dolor en fosa ilíaca derecha de carácter cólico, que se aliviaba con la defecación. Entre sus antecedentes familiares destacaba una hija con enfermedad celíaca.
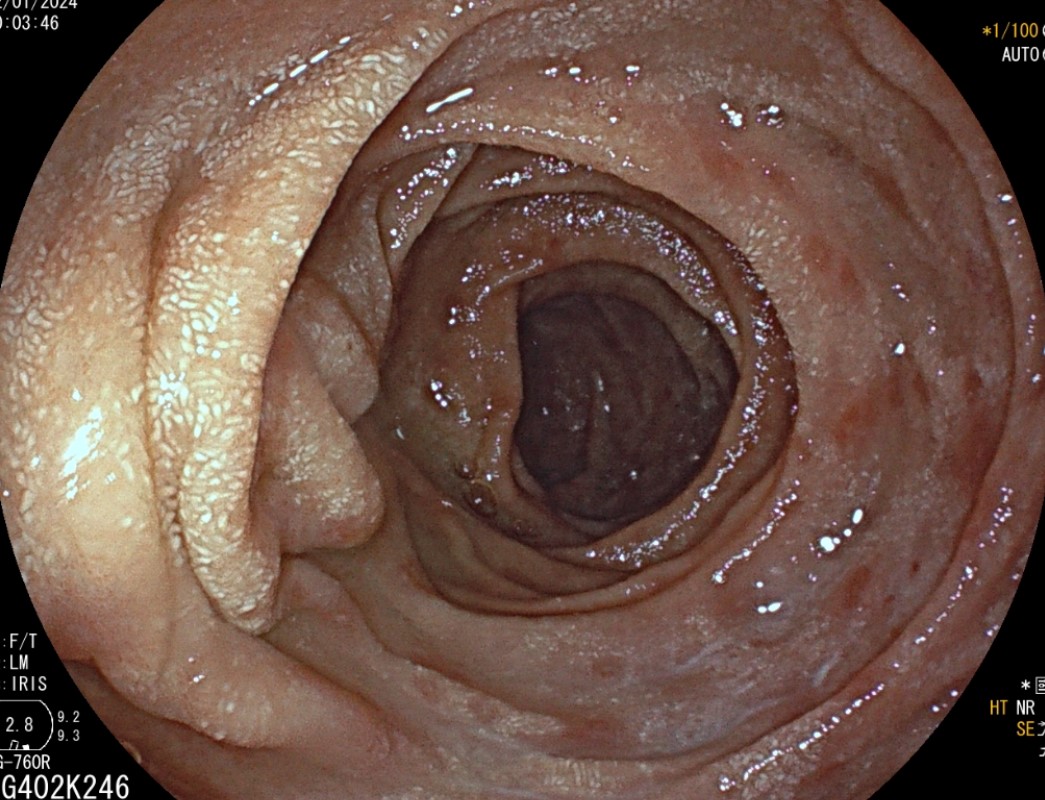
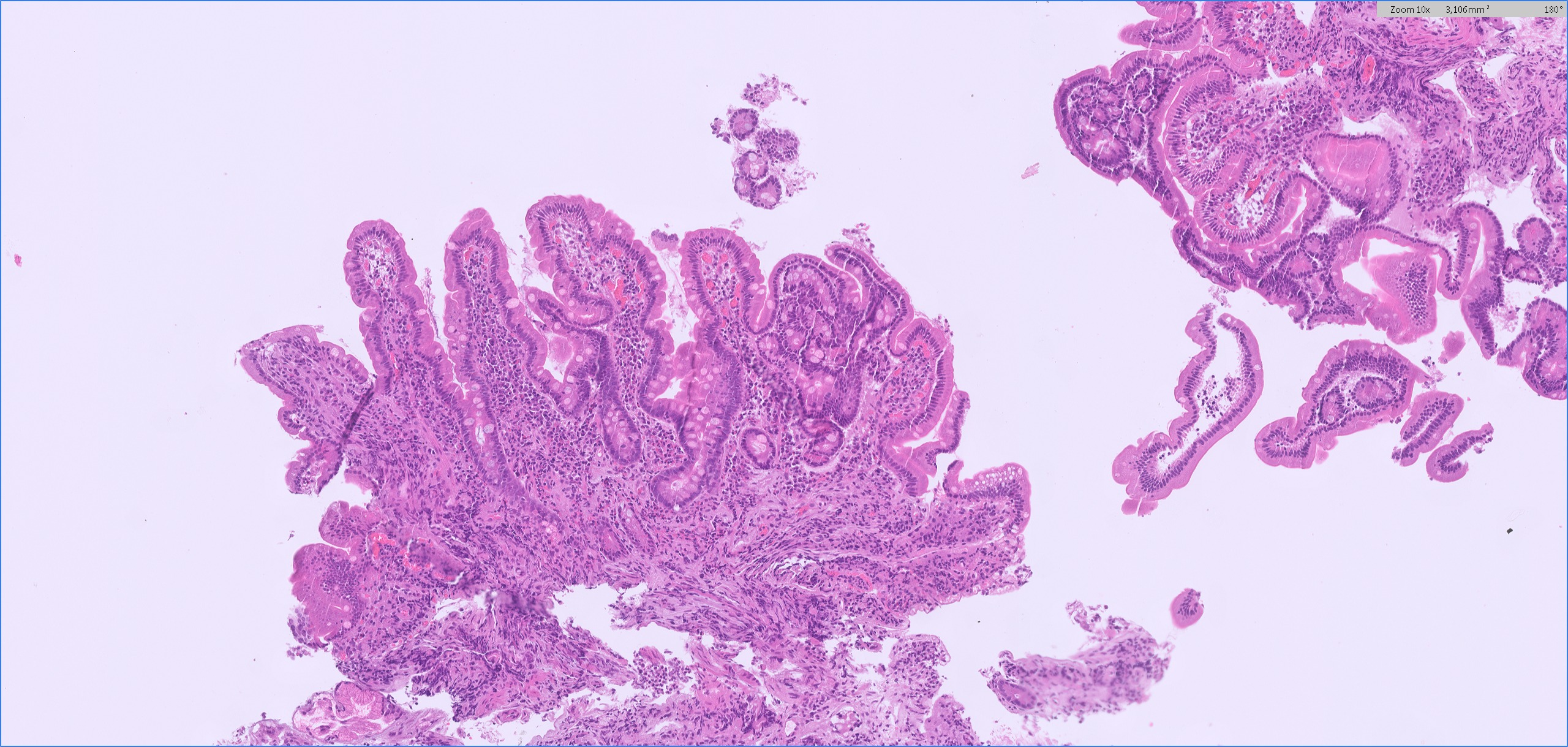
Se realizó analítica en la que se observaba una discreta anemia ferropénica, siendo los anticuerpos anti-transglutaminasa normales; además de coprocultivo y estudio de toxina de Clostridioides difficile, que resultaron ser negativos. Asimismo, se solicitó endoscopia digestiva alta donde a nivel macroscópico se observaron únicamente signos de gastritis crónica con duodeno con leve eritema puntiforme (Figura 1), y colonoscopia donde se visualizaron tres úlceras superficiales en ciego. En las biopsias duodenales se observó una marcada atrofia vellositaria con infiltrado linfocitario pan-mucoso y linfocitosis intraepitelial prominente (Figuras 2 y 3), encontrando un infiltrado inflamatorio crónico inespecífico en las biopsias del ciego. Se decidió retirar Olmesartán, tras lo cual la paciente experimentó una importante mejoría clínica, disminuyendo el número de deposiciones hasta normalizarse y recuperando el peso perdido.
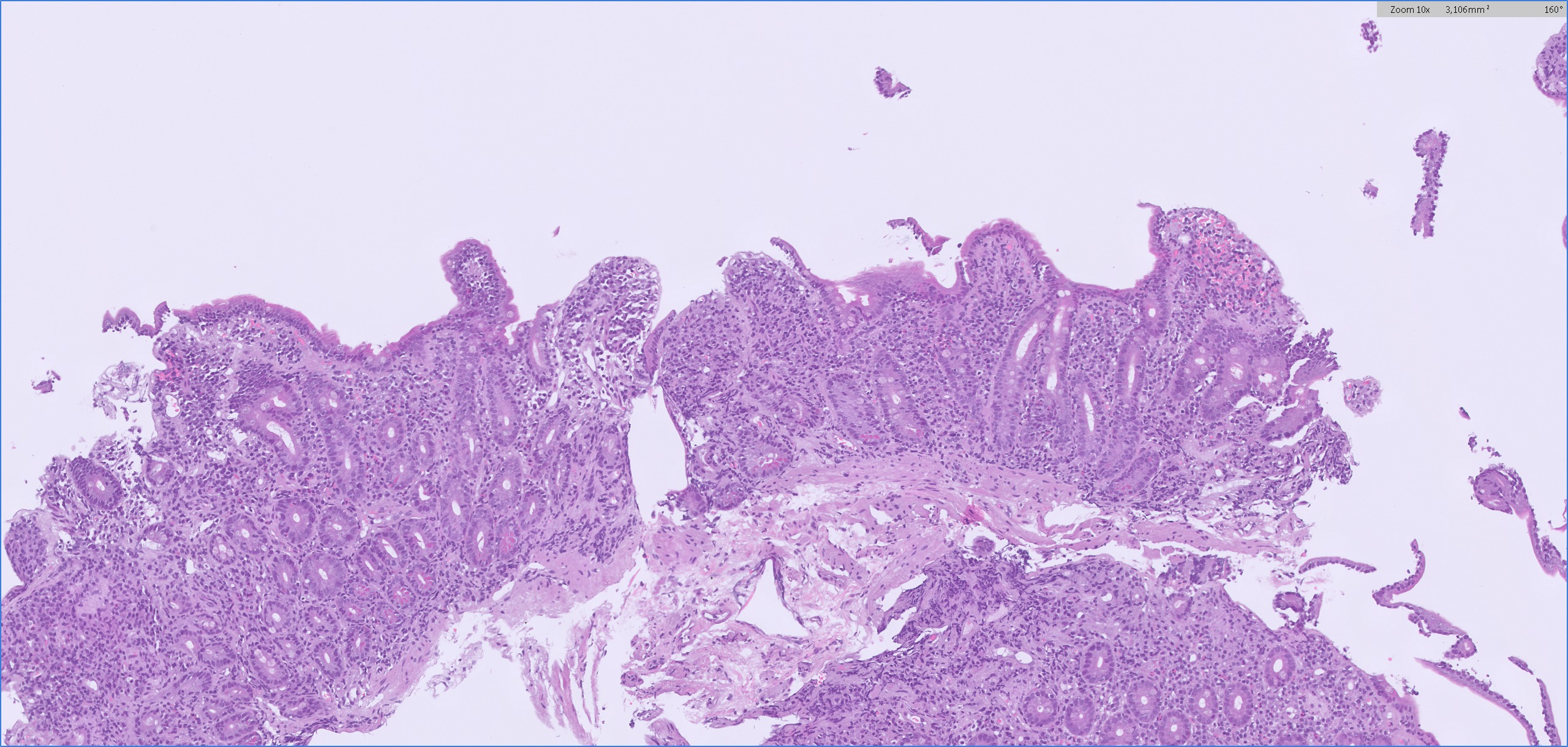
Figura 2
Biopsias incisionales endoscópicas de la segunda porción duodenal, al diagnóstico. Marcada atrofia vellositaria y acortamiento vellositario con infiltrado linfocitario crónico panmucoso.
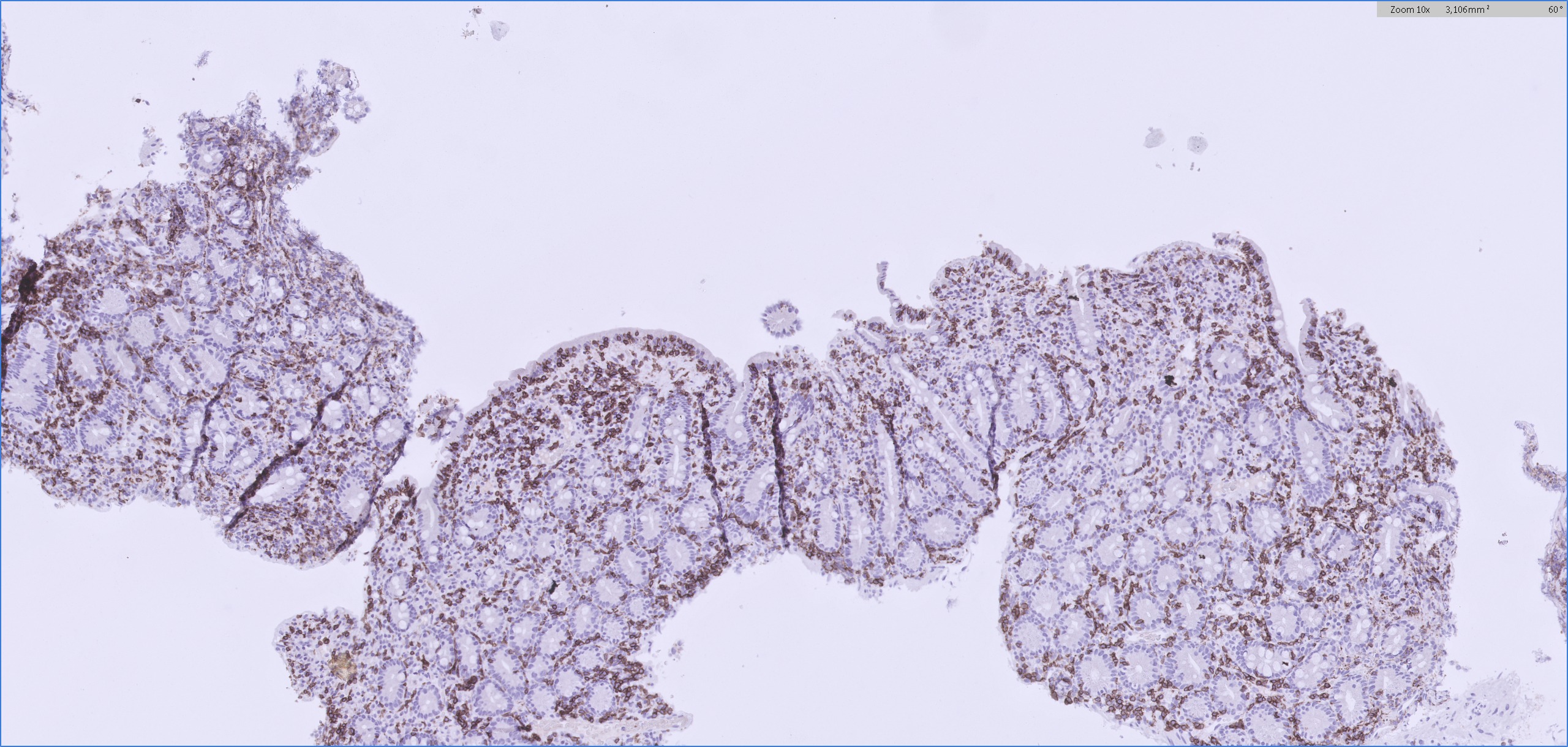
Figura 3
Biopsias incisionales endoscópicas de la segunda porción duodenal. relevante lincofictosis intraepitelial cuantificados mediante la técnica inmunohistoquímica CD3.
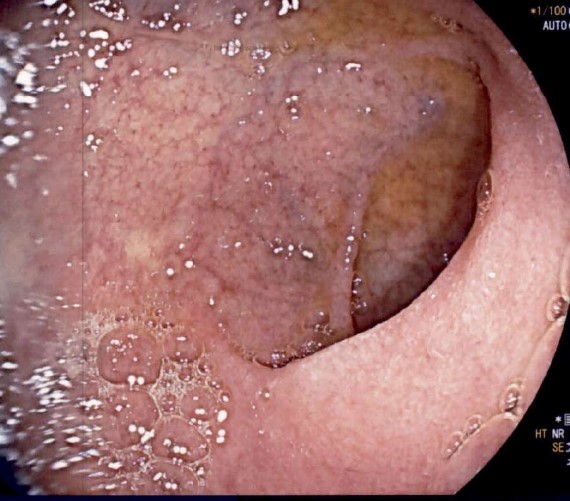
Tras dos meses de evolución, y teniendo en cuenta los antecedentes familiares de la paciente, se decidió realizar nueva EDA (Figura 4) con toma de biopsias en la que se objetivó una normalización de los hallazgos histológicos a nivel duodenal (Figura 5).
Discusión
La atrofia vellositaria duodenal con infiltrado inflamatorio seronegativo para enfermedad celíaca supone un reto diagnóstico. Dentro del diagnóstico diferencial debemos considerar la enteropatía autoinmune, enfermedad de Crohn, enteritis eosinofílica, giardiasis, esprúe tropical, enfermedad de Whipple, enfermedad de injerto contra huésped, inmunodeficiencia variable común, sobrecrecimiento bacteriano, patología neoplásica (linfomas) y origen medicamentoso (azatioprina, metrotexato, micofenolato de mofetilo, etc.)[3]-[6].
Desde el estudio de Rubio-Tapia J et al. en el año 2012[1] en el que por primera vez se describió la asociación entre el Olmesartán y enteropatía, y a pesar de que algunos estudios han puesto en duda la misma[7], se han sucedido múltiples trabajos en la literatura que han expuesto dicha relación[2],[3],[5],[6],[8]-[18].
Los mecanismos fisiopatológicos que sustentan dicha asociación son aún desconocidos. Debido al periodo prolongado de latencia entre la introducción de Olmesartán y la aparición de diarrea, parece que la respuesta inmunitaria involucrada es fundamentalmente de tipo IV.
Por otra parte, parece que los ARA-II inhiben el TGF-β, molécula implicada en el mantenimiento de la homeostasis intestinal. Asimismo, la enteropatía asociada a Olmesartán comparte muchas características inmunológicas con la enfermedad celíaca no tratada, como el incremento de linfocitos T CD8+, sobreexpresión de IL-15 o disrupción de la proteína zonulina-1[2],[15]. Otra teoría postula que la inhibición mayoritaria de los receptores de angiotensina tipo 1 (AT-1) debido a elevada especificidad del Olmesartán por los mismos, produce que la angiotensina se una al receptor AT-2, que tiene una función pro-apoptótica de los enterocitos ampliamente conocida[6].
Por otra parte, algunos trabajos sugieren la enteropatía asociada a Olmesartán puede exhibir otro fenotipo endoscópico e histológico relacionado con una reacción de hipersensibilidad de tipo I, con aparición de nódulos ileales con duodeno normal, así como un infiltrado histológico monocitario y eosinofílico sin evidencia de atrofia vellositaria[10].
La enteropatía asociada al Olmesartán afecta a ambos sexos por igual y se presenta fundamentalmente en la séptima y octava décadas de la vida[4]. Se caracteriza por la presencia de diarrea crónica, pérdida de peso y esteatorrea, pudiendo presentar otros síntomas de la esfera digestiva como náuseas, vómitos, distensión abdominal y astenia, la ausencia de anticuerpos asociados a celiaquía así como la nula respuesta a dieta sin gluten; además, deben observarse hallazgos histológicos de enteropatía (linfocitosis intraepitelial, atrofia vellositaria y depósito de colágeno subepitelial)[4], que no solo aparecen en el duodeno sino que pueden presentarse a lo largo de todo el tracto gastrointestinal; no obstante, parece que principalmente son las alteraciones histológicas en el duodeno las que determinan el fenotipo clínico de esta entidad, siendo los cambios patológicos gástricos y colónicos de menor importancia[2].
Asimismo, deben excluirse otras causas de enteropatía y es necesario evidenciar una mejoría clínica tras la retirada del Olmesartán[1]. Las alteraciones analíticas son inespecíficas, siendo lo más frecuente la aparición de anemia normocrómica normocítica e hipoalbuminemia[4].
El tiempo medio de aparición de la enteropatía es de 3,1 años (rango de 6-120 meses), por lo que es necesario considerar esta entidad independientemente del tiempo en el que el paciente ha estado en tratamiento con Olmesartán[9].
EL papel de la genética en la patogenia de esta entidad es desconocido. La presencia de HLA-DQ2 y HLA-DQ8 ocurre hasta en el 70% de los pacientes, sin que dicha ello sea necesario para la aparición de la enteropatía. La mayor parte de pacientes son seronegativos frente a los anticuerpos anti-enterocito[1],[5],[6].
En relación con el diagnóstico endoscópico solo es necesario realizar endoscopia digestiva alta en un primer abordaje. En el caso de que no se objetiven alteraciones endoscópicas ni histológicas en el duodeno, se podrá plantear la relación de colonoscopia para identificar posibles alteraciones mucosas e histológicas en el colon compatibles o no con esta entidad.
La enteropatía asociada a Olmesartán no es un efecto adverso único de este ARA-II, sino que también ha sido descrito en el caso de Telmisartán, Valsartán e Irbesartán[2].
El tratamiento de la enteropatía asociada a Olmesartán consiste en la suspensión inmediata del fármaco, respondiendo la totalidad de los pacientes siempre que el diagnóstico y asociación causal inicial hayan sido correctos, con normalización de las deposiciones, alteraciones analíticas y ganancia de peso. En aquellos casos infrecuentes en los que el paciente presente una mejoría lenta, algunos trabajos señalan la posible utilidad de Budesonida[19].
El pronóstico a corto y largo plazo de los pacientes es excelente, cediendo completamente los síntomas al suspender el fármaco. Debido a ello, y en el caso de una adecuada respuesta al cese del fármaco, no es necesario realizar una endoscopia de control para observar la resolución de las alteraciones histológicas iniciales, siendo esto una estrategia coste-efectiva.

 Descargar número completo
Descargar número completo Download full issue
Download full issue