CORRESPONDENCIA
José Manuel Pérez Pozo
Centro Hospitalario de Alta Resolución de Utrera. Sevilla.
41710 Utrera, Sevilla
CITA ESTE TRABAJO
Pérez Pozo JM. Sobrecrecimiento bacteriano. ¿Vamos por el buen camino? RAPD 2024;47(1):22-31. DOI: 10.37352/2024471.2
Introducción
En los últimos tiempos hemos asistido a una extraordinaria divulgación del sobrecrecimiento bacteriano intestinal (SBI) en las redes sociales, apareciendo numerosos vídeos en los que "influencers" y usuarios exponen cómo sus síntomas (habitualmente hinchazón, distensión abdominal, diarrea..) se deben a esta patología, fácilmente diagnosticable mediante un test de aliento y cómo se resuelven tras tratamiento antibiótico. Esto supone que muchos pacientes acudan a la consulta preguntando directamente por esta enfermedad como si se tratara de una patología nueva y emergente. Por otro lado, sobre todo a partir de la segunda mitad de la década pasada, existe un notable incremento en las publicaciones científicas sobre el tema, debido, por un lado al mayor interés en la microbiota y su papel en algunas enfermedades y, sobre todo, a la popularización de los test de aliento como forma de diagnóstico. Pero en realidad estamos ante una entidad conocida desde hace muchas décadas. Ya en 1890 White y posteriormente Barker en 1939 describieron una serie de pacientes con anemia megaloblástica asociada a alteraciones del intestino delgado, como estenosis. Card en 1959 describe perfectamente el cuadro clínico clásico, en el que diversas condiciones en el intestino delgado como diverticulosis masiva o estenosis, provocaban una clínica similar, con malnutrición, anemia y esteatorrea. En 1960 Badenoch describe el espectro clínico del SBI, indicando la existencia de un grupo médico y quirúrgico[1]-[3]. Estamos por tanto ante una enfermedad conocida y descrita desde hace tiempo. Definición Aunque no existe una definición unánime, la más aceptada define al SBI como aquella condición clínica cuyos síntomas o signos están causados por la presencia de un excesivo y/o anormal tipo de bacterias en el intestino delgado, más propias del colon. Inicialmente se establecía el número de 100.000 unidades formadoras de colonias (UFC) por mililitro (ml) como el mínimo para establecer el diagnóstico, cuando éste se realizaba mediante aspirado yeyunal. Esto se basaba en los estudios de SBI clásico, en pacientes con alteraciones anatómicas. Estudios más recientes indican que en voluntarios sanos es raro encontrar más de 100-1.000 UFC /ml en aspirado duodenal-yeyunal, de manera que éste es el valor en la actualidad aceptado por la mayoría de autores[4].
Factores de riesgo
Como se ha comentado previamente el duodeno presenta un escaso número de bacterias, habitualmente menos de 1.000 UFC /ml, fundamentalmente lactobacilos y estreptococos. A medida que avanzamos a tramos más distales vamos a ir encontrando mayor población bacteriana: 10.000 UFC /ml en yeyuno y 1.000.000 en íleon distal. El colon se encuentra densamente poblado por anaerobios, habitualmente más de 1.000.000.000.000 UFC /ml. El intestino delgado, por tanto, a pesar de su longitud es una zona en la que vamos a encontrar un número relativamente bajo de bacterias, en especial en los tramos más proximales. Existen varios factores que favorecen este hecho. Uno de los más importantes va a ser la actividad motora intestinal, sobre todo el complejo mayor migratorio interdigestivo fase III, una potente contracción tónica que se genera en estómago distal y duodeno proximal durante las fases de ayuno y que tiene un importante papel en el aclaramiento del contenido y bacterias intestinales. Por otro lado, las secreciones gástricas y bilio-pancreática también ejercen un papel antiséptico. La integridad de la mucosa intestinal y una adecuada flora comensal también contribuyen. Finalmente la competencia de la válvula ileocecal dificulta el acceso de bacterias y material colónico al intestino delgado[5].
Teniendo en cuenta estos factores protectores, es fácil entender cuáles son las condiciones que van a facilitar el sobrecrecimiento bacteriano (tabla 1)[5]:
Tabla 1
Condiciones asociadas a sobrecrecimiento bacteriano.
- Alteraciones en la motilidad intestinal. Va a ser uno de los factores más determinantes. Así, podemos encontrar estas alteraciones en: neuropatía diabética, esclerosis sistémica, uso crónico de opioides, uso de fármacos anticolinérgicos, hipotiroidismo.
- Alteraciones anatómicas, en especial aquellas que condicionan un estasis del contenido intestinal: diverticulosis del intestino delgado, modificaciones quirúrgicas (Billroth II, anastomosis término-lateral), estenosis (enfermedad de Crohn, radiación cirugía), asas ciegas, fístulas yeyuno-cólicas y, como se ha comentado, cuando se pierde la función de la válvula ileocecal (incompetencia o resección).
- Disminución de la secreción gástrica, sobre todo postquirúrgica. En cuanto al uso crónico de inhibidores de la bomba de protones, aunque algunos estudios muestran un mayor riesgo de SBI cuando se toman de forma prolongada, parece ser un factor más concomitante que exclusivo para el desarrollo de esta enfermedad.
- Inmunodeficiencias que implican una pérdida de la capacidad defensiva de la mucosa: inmunodeficiencias congénitas, déficit de Ig A o inmunodeficiencias adquiridas (SIDA o malnutrición).
- Mecanismo multifactorial: pancreatitis crónica (disminución de la secreción pancreática, alteración de la motilidad por el proceso inflamatorio, uso de analgésicos opioides que disminuyen la motilidad), enfermedad celíaca (alteración motilidad, disminución capacidad defensiva de la mucosa, asociación a insuficiencia pancreática), enfermedad de Crohn (presencia de estenosis, fístulas, pérdida capacidad defensiva de la mucosa), enfermedad hepática, insuficiencia renal terminal y otras entidades menos frecuentes reflejadas en la tabla 1.
Un punto importante es que igual que no debemos sobrediagnosticar el SBI en algunos casos, también debemos tener en cuenta esta entidad en circunstancias que reúnen algunos de los factores predisponentes previamente enumerados, pues puede ser importante en el manejo clínico de estos pacientes, como: edad avanzada, con un riesgo relativo (RR) 2-3 veces superior, en especial en casos de diarrea y malnutrición, diabetes mellitus (RR 4.18), esclerodermia (RR 12.21), enfermedad celíaca (RR 5.1), enfermedad de Crohn (RR 10.9) o cirrosis hepática (RR 6.8) [6].
Fisiopatología
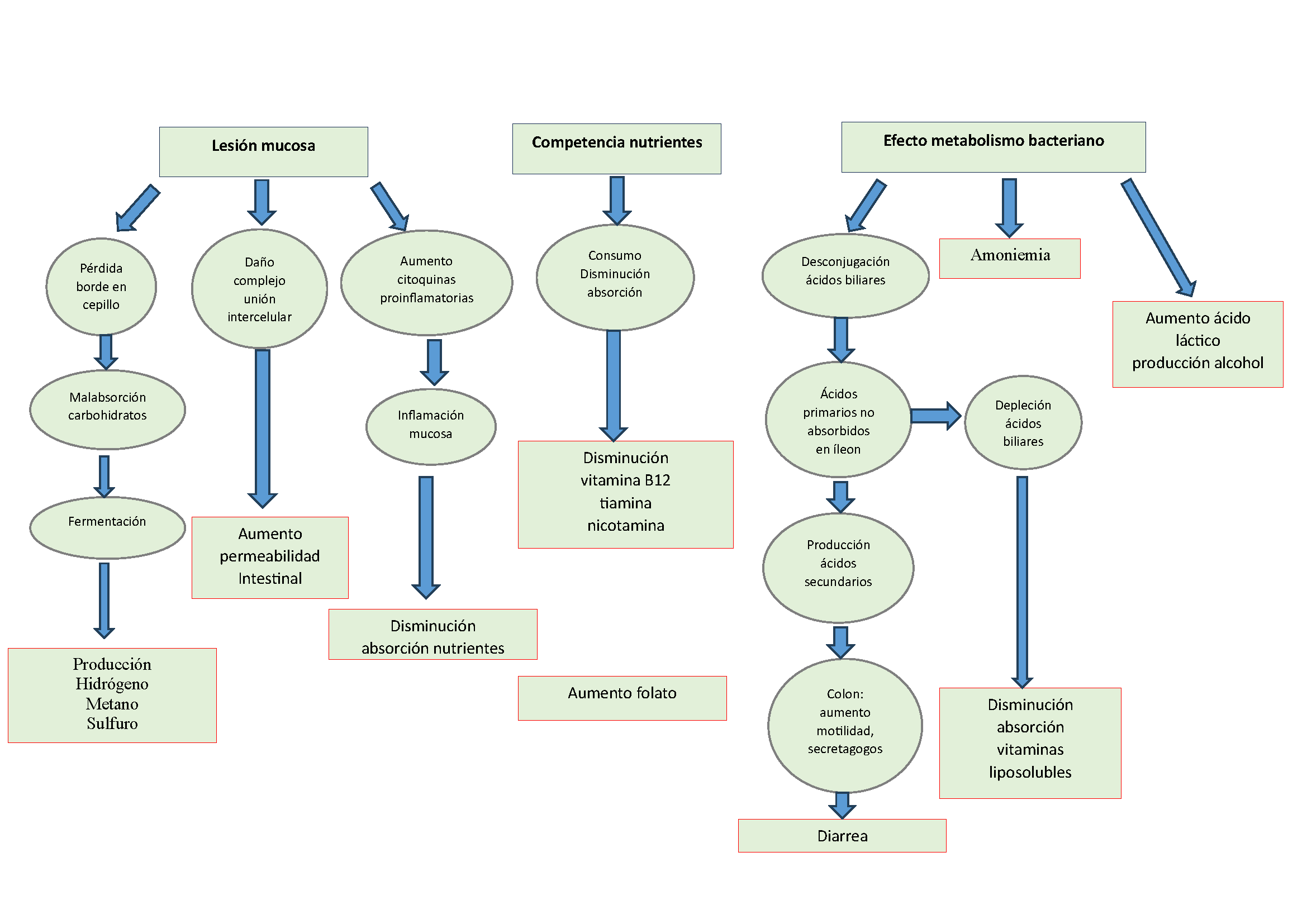
Gran parte de los conocimientos en cuanto a la fisiopatología del SBI proceden de estudios de casos clásicos de mala digestión / malabsorción en pacientes con factores anatómicos predisponentes (estenosis, cirugía…) en los que esta entidad es capaz de provocar un cuadro de malabsorción y malnutrición. Las vías por las que puede producirse esta clínica son: por lesión mucosa, por competencia por nutrientes del huésped y por efecto del metabolismo bacteriano (Figura 1)[5].
Figura 1
Fisiopatología de la maladigestión / malabsorción en el sobrecrecimiento bacteriano intestinal.
Lesión mucosa
La colonización excesiva por bacterias más propias del colon en intestino delgado puede provocar una pérdida del borde en cepillo del enterocito, con la correspondiente malabsorción de carbohidratos, que van a ser fermentados por estos microorganismos, con la consiguiente producción en exceso de gases como hidrógeno, metano o sulfuro de hidrógeno. Por otro lado , por efecto de las bacterias o sus enterotoxinas, como el lipopolisacárido de Escherichia Coli, se produce un daño en los complejos de unión intercelular, dando como resultado un aumento en la permeabilidad intestinal. Finalmente el daño mucoso genera una activación de citoquinas proinflamatorias que aumenta la lesión tisular y puede provocar una disminución en la absorción de nutrientes.
Competencia por nutrientes del huésped
El SBI se asocia típicamente a un déficit de vitamina B12, tanto por consumo bacteriano como por disminución de absorción. También se genera una reducción en los niveles de tiamina y nicotinamida. Curiosamente se produce un aumento del folato, que es sintetizado por las bacterias.
Efecto del metabolismo bacteriano
Una de las consecuencias con mayor relevancia clínica es que la colonización anormal de bacterias en intestino delgado genera una desconjugación de sales biliares, lo cual produce un exceso de ácidos primarios no absorbidos en íleon, que se metabolizan a ácidos secundarios y terciarios, que en colon aumentan la motilidad intestinal y actúan como secretagogos, siendo éste uno de los factores más importantes para generar diarrea en el SBI. Además, esto puede suponer una depleción de ácidos biliares, con la consiguiente disminución de vitaminas liposolubles. Finalmente, otras consecuencias del metabolismo bacteriano son la hiperamoniemia y el aumento del ácido láctico y producción de alcohol.
Por tanto, tenemos una entidad que es una causa reconocida de malabsorción, esteatorrea y malnutrición y que puede revertirse con un tratamiento antibiótico. La cuestión que surge es si el SBI, sin llegar a provocar un cuadro de malabsorción podría ser responsable de síntomas como hinchazón, distensión, dolor abdominal y diarrea, comunes en el síndrome de intestino irritable. Como hemos visto, esta condición potencialmente es capaz de producir desconjugación de sales biliares, aumento de hidrógeno y metano, generar un estado de inflamación mucosa crónica y aumentar la permeabilidad intestinal, todo lo cual son conceptos fisiopatológicos reconocidos en la etiopatogenia del síndrome de intestino irritable (SII). Por tanto, ¿podría el SBI como una forma de disbiosis estar detrás de los síntomas de una parte de los pacientes diagnosticados de SII?. Antes de tratar de contestar a esta cuestión vamos a exponer los métodos diagnósticos de los que disponemos en la actualidad, pues va a ser unos de los factores más limitantes que vamos a encontrar.
Métodos diagnósticos
Los métodos disponibles para el diagnóstico del SBI son:
- Cultivo de aspirado duodenal-yeyunal, considerado tradicionalmente como el "gold standard".
- Test de aliento hidrógeno-metano espirado, usando dos sustratos: glucosa y lactulosa.
- Nuevas técnicas: cápsula gas intestinal, secuenciación RNA ribosomal 16s….
Cultivo de aspirado duodenal-yeyunal
Considerado como el "gold estándar" o al menos el mejor método diagnóstico. Generalmente se realiza un aspirado del contenido intestinal a nivel de 3ª-4ª porción duodenal, tomando 3-5 ml con un catéter con múltiples orificios laterales. Algunos autores utilizan un catéter de doble luz para minimizar la contaminación orofaríngea. Posteriormente se realiza un cultivo aerobio-anaerobio en ágar MacConkey o ágar sangre. Como se ha comentado anteriormente el límite para considerarlo positivo se establece en la actualidad en más de 1.000 UFC /ml. El principal problema es que es una técnica que consume tiempo, tiene un coste importante y conlleva los riesgos inherentes a la endoscopia y sedación y, por tanto, no se va a realizar en la práctica clínica habitual. Además, tiene el problema de la contaminación orofaríngea, que puede estar presente en el 20 % de los casos. Por otro lado, sólo se van a conseguir cultivar el 20-30 % de bacterias y, dado que el aspirado es duodenal, no detecta el SBI distal[7].
Test de aliento con hidrógeno-metano espirado
Basados en el hecho de que los mamíferos no son capaces de producir ciertos gases como hidrógeno, metano y sulfuro de hidrógeno y, por tanto, su aparición en aliento tras administrar un azúcar indica fermentación bacteriana a nivel intestinal. Se van a usar dos sustratos: glucosa y lactulosa, que conceptualmente son diferentes. La glucosa es un monosacárido que una vez administrado va a ser rápidamente absorbido en el intestino proximal. En el caso de existir un SBI los microorganismos compiten con el huésped, de manera que parte no va a ser absorbida y va ser fermentada, con la consiguiente producción de hidrógeno, metano y sulfuro que difunden rápidamente a la sangre, llegan a los alveolos y son eliminados vía respiratoria de forma precoz. La lactulosa es un disacárido sintético que el organismo no es capaz de digerir ni absorber a nivel intestinal, llegando inalterado al intestino grueso, donde es fermentado. En el caso de la existencia de un SBI parte de la lactulosa es fermentada en intestino delgado originando un pico precoz de hidrógeno, sulfuro y en ocasiones metano[8].
Una de las principales limitaciones que vamos a encontrar al utilizar los tests de aliento son los falsos positivos cuando existe un tránsito intestinal rápido, que puede provocar un pico precoz de gases cuando el sustrato ha llegado ya al colon. Este problema va a ser mayor cuando usamos lactulosa, aconsejando algunos autores una medida concomitante del tiempo de tránsito intestinal mediante gammagrafía, lo cual va a ser inviable en la mayoría de los casos. También pueden aparecer falsos positivos en situaciones que provoquen una exposición proximal aumentada de glucosa, como en la gastrectomía parcial, si bien en la práctica clínica va a ser menos relevante. También pueden existir falsos negativos, sobre todo en situaciones que provoquen un enlentecimiento del tránsito del bolo (achalasia, obstrucción a la salida gástrica o fístula enterocutánea proximal). Otra causa de falsos negativos puede ser la absorción de glucosa proximal a la zona de sobrecrecimiento, sobre todo si éste es distal[9].
Los criterios diagnósticos que se van a utilizar en la mayoría de los casos son los publicados en el consenso norteamericano. En él se recomiendan utilizar 75 gramos de glucosa ó 10 de lactulosa, con medición posterior de hidrógeno, metano y C02 en las siguientes tres horas cada 30 minutos. Se considera positivo una elevación de los niveles de hidrógeno sobre el nivel basal mayor de 20 partes por millón (ppm) en los primeros 90 minutos o de más 10 ppm de metano en cualquier momento del estudio[10]. Sin embargo, el consenso europeo publicado más recientemente, aunque aconseja administrar 50 gramos de glucosa, con una duración del estudio de 120 minutos, concluye que no se pueden establecer unos criterios diagnósticos uniformemente aceptados, debido a la interpretación limitada de los resultados por la presencia de varios factores de confusión, en especial la variabilidad en el tránsito orocecal[11]. Algunos estudios que comparan el cultivo del aspirado intestinal con el test de aliento muestran una concordancia sorprendentemente baja, con un índice kappa de -0,02[12].
El rendimiento diagnóstico se va establecer comparándolo con el cultivo del aspirado intestinal, que como se ha comentado no es el mejor "gold standard" posible. Usándolo como referencia la sensibilidad del test de glucosa va a ser del 54 %, mientras que el de lactulosa es del 42 %. En cuanto a la especificidad, el de glucosa es del 83 %, siendo del 71 % en el de lactulosa. Una de los parámetros más importantes a tener en cuenta es la razón de verosimilitud positiva (RVP) (cociente entre la probabilidad de que un test positivo tenga la enfermedad y la probabilidad de que uno negativo la tenga) y la razón de verosimilitud negativa (RVN) (cociente entre la probabilidad que un test negativo tenga la enfermedad entre la probabilidad que el test negativo no la tenga). En el caso del primer parámetro se considera un test excelente si el valor es igual a superior a 10, bueno entre 5-10 y aceptable entre 2-5. En el caso del segundo, excelente si es igual o menor a 0,1, bueno entre 0,1 y 0,2 y aceptable entre 0,2 y 0,5. El test de glucosa muestra una RVP de 2,45, siendo la RVN de 0.60. Por su parte el test de lactulosa muestra una RVP de 1,30 y una RVN de 0,79, es decir unos valores muy discretos, en especial cuando se usa lactulosa. En cuanto al área bajo la curva (relación entre sensibilidad y especificidad, valor ideal 1) es de 0,7418 en el caso del test de glucosa y de 0,5582 en el caso del de lactulosa[13].
Nuevas técnicas
-Cápsula de gas intestinal. Es un dispositivo que una vez ingerido permite medir y transmitir de forma inalámbrica y en tiempo real los niveles de hidrógeno y metano tras la ingesta de un azúcar en los diferentes segmentos intestinales. De esta manera no interfiere el tiempo de tránsito orocecal. Es una técnica casi experimental y usada en muy pocos centros siendo, por tanto, muy limitado su impacto clínico[14].
-Secuenciación del RNA ribosomal 16s en aspirado de contenido intestinal. El RNA ribosomal 16 s es un pequeño fragmento de RNA de la subunidad menor del ribosoma de las células procariotas. Su secuencia ha permanecido inalterada, sin mutaciones, a lo largo de miles de años y es específica para cada bacteria. Su secuenciación mediante las nuevas técnicas de alto rendimiento permite determinar las bacterias de una muestra y realizar una clasificación taxonómica de la misma, estudiando la diversidad. Estudios que utilizan esta técnica junto con el cultivo de aspirado muestran que los pacientes con SBI presentan un descenso en la diversidad alfa, más acusado cuanto mayor es el sobrecrecimiento bacteriano, y el predominio de ciertas bacterias como Escherichia Coli, Shigella y Klebsiella[15]. También muestra que los pacientes con hinchazón o distensión abdominal funcional presenta igualmente una disminución en la diversidad bacteriana, con aumento de proteobacterias y descenso en actinobacterias y esta disminución en la diversidad bacteriana además es más acusada cuando asocian un SBI[16].
Relación sobrecrecimiento bacteriano intestinal - síndrome de intestino irritable.
Como se ha planteado anteriormente, la cuestión que nos surge es si el SBI, sin llegar a provocar cuadro un cuadro de malabsorción, con diarrea, malnutrición y déficit de nutrientes puede jugar cierto papel en la etiopatogenia de algunos pacientes con síndrome de intestino irritable (SII). La principal limitación que nos vamos a encontrar a la hora de interpretar los diferentes trabajos que estudian esta asociación es que son muy heterogéneos entre sí y es difícil sacar conclusiones globales, pues usan diferentes técnicas diagnósticas (aspirado, test de aliento), con diferentes sustratos, puntos de corte diagnóstico y criterios clínicos de selección. Además, como se ha comentado, la mayoría basan el diagnóstico en los tests de aliento espirado que, como se ha explicado previamente, presentan una baja sensibilidad, especificidad y están influidos por varios factores de confusión.
Uno de los primeros trabajos que relacionaban ambas entidades fue el publicado por Mark Pimentel (unos de los autores con más estudios sobre microbiota, SBI y relación con el SII), publicado en el año 2000. En este estudio con 202 pacientes con SII según criterios Roma I, al realizar test aliento con lactulosa, el 78 % de éstos resultaban positivos y, además, en los que se objetivaba la negativización del test de aliento tras tratamiento antibiótico, tenían una mejoría sintomática significativa respecto a aquellos que no negativizaban tras tratamiento[17]. Sin embargo, posteriormente fueron surgiendo estudios con resultados contradictorios, que no encontraban una mayor prevalencia de SBI en pacientes con SII[18]. En 2009 se publica uno de los primeros meta-análisis, que incluía 12 estudios, todos de más de 90 casos, tanto de series como de casos-controles. Se encuentra que, respecto a controles, los pacientes con SII presentan un RR entre 3.45-4.7, según el punto de corte diagnóstico utilizado. En este trabajo llama la atención la gran diferencia en la prevalencia de SBI según el método diagnóstico utilizado (54 % cuando se usa test de lactulosa, 31 % con glucosa y 4 con aspirado yeyunal >100.000 UFC / ml)[19]. En otro los más importantes meta-análisis, publicado en 2018 se encuentra un RR de SBI en SII de 4.7 (3.5 tras ajustar sesgo de publicación). La prevalencia global era del 38 %, pero igualmente variaba según el método diagnóstico empleado (19 % en aspirado yeyunal, 31 % con test de glucosa y 47 % con lactulosa). Además, ésta era más alta en paciente con SII subtipo diarrea (42 %), frente a otros subtipos de SII (25 % estreñimiento, 31 % mixto ó 17 % indeterminado[20]. Uno de los últimos y más importante meta-análisis fue publicado en 2020, incluyendo 3192 pacientes con SII frente 3320 controles. El RR de SBI en pacientes con SII fue de 3,7 (4,9 en los estudios con controles sanos), siendo más frecuente en el subtipo diarrea, con un RR de 1.86 en comparación al subtipo estreñimiento. En este estudio llama la atención que, frente al test de glucosa, el test de aliento con lactulosa tenía una tasa de positivos 3,5 veces mayor en pacientes con SII y 7,8 en controles[21].Finalmente, uno de los últimos meta-análisis publicados que incluye más de 5300 pacientes refleja una positividad del 36. % con cualquier test, con un riesgo relativo de 4,2 al usar glucosa y de 3,2 al usar cultivo de aspirado yeyunal. En este meta-análisis el riesgo relativo con lactulosa fue sólo del 1,6, sin diferencias estadísticamente significativas, atribuido por los autores a la alta tasa de falsos positivos por el aumento de tránsito orocecal. Igualmente fue más frecuente en el subtipo diarrea (RR de 1.4 frente a otros subtipos)[22]. Aunque los síntomas más frecuentemente relacionados con el sobrecrecimiento son hinchazón, distensión y dolor abdominal, sólo la diarrea, tanto antes, como durante el test aliento con glucosa, mostró unos valores significativos (aunque modestos) como predictor de la presencia de SBI[13].
Sobrecimiento intestinal metanogénico
La infusión de metano en el intestino de modelos animales induce una disminución del tránsito intestinal, aumentando la contractibilidad y reduciendo la velocidad de la onda peristáltica. Los principales productores de metano en el organismo son las arqueas, que constituyen un tercer dominio, junto con las células procariotas y las eucariotas. En concreto, Methanobrevibacter Smithii, va a ser la principal arquea productora de metano, que la vamos a encontrar no sólo en el intestino delgado, también en colon. Por todo esto, para unir todos estos conceptos, algunos autores aconsejan usar el término sobrecrecimiento intestinal metanogénico[4]. En un meta-análisis con 1654 pacientes con SII frente a 713 controles se evidenció una positividad del test de aliento midiendo metano del 29 % con lactulosa y del 11,5 % utilizando glucosa, con un RR de 1,2 en pacientes con SII. La prevalencia fue notablemente mayor en los pacientes con subtipo estreñimiento (37,7 % frente a 12,4 % en subtipo diarrea, con un RR de 3,1). En el mismo estudio se evidenciaba que los pacientes con enfermedad inflamatoria intestinal presentaban menor tasa de positivos del test con metano en relación a controles sanos[23].
En resumen, diferentes trabajos y meta-análisis muestran una mayor positividad de las pruebas usadas para el diagnóstico del SBI (fundamentalmente test de aliento y en menor medida cultivo de aspirado intestinal) en pacientes con SII, aunque la gran heterogeneidad en los estudios en cuanto a selección de pacientes, método usado, criterios diagnósticos y baja sensibilidad y especificidad de las pruebas utilizadas obligan a tomar estos datos con cautela.
Tratamiento
Como en otros aspectos de esta entidad las recomendaciones en cuanto al tratamiento se basan en estudios con gran heterogeneidad y, en algunos casos, series pequeñas de pacientes. Las opciones que tenemos en el tratamiento son: dieta, probióticos, trasplante de microbiota fecal y antibióticos.
En cuanto a la dieta, el objetivo sería la reducción de productos potencialmente fermentables. Algunos estudios muestran que la dieta FODMAP reduce los productos de fermentación bacteriana, medidos por el test de aliento. Sin embargo, no existe un nivel de evidencia suficiente para recomendar la dieta FODMAP en estos pacientes[4].
Algunos estudios muestran que la administración de probióticos reduce la producción de hidrógeno medido en aire espirado, aunque igualmente el nivel de evidencia es bajo para recomendar su uso. El trasplante de microbiota fecal es anecdótico en esta entidad y como curiosidad, un trabajo mostró que los pacientes con colitis por Clostridium Difficile que recibían el trasplante procedente de donantes con test de sobrecrecimiento bacteriano patológico (mediante test de aliento) presentaban más síntomas como distensión abdominal respecto a los donantes no positivas en el test de aliento[4].
Los antibióticos van a ser el principal brazo terapéutico cuando planteemos un tratamiento en el SBI. El objetivo al usarlos no sería erradicar la microbiota intestinal, sería modularla para provocar una mejoría sintomática. Hay que tener en cuenta que se va tratar de un tratamiento empírico, pues no vamos a disponer en la inmensa mayoría de los casos de cultivo y antibiograma. Debe cubrir bacterias aerobias y anaerobias. Generalmente va a ser suficiente un tratamiento único de 7-10 días. Hay que tener en cuenta que las recaídas son frecuentes (hasta un 44 % en 9 meses). No va a ser necesario repetir el test diagnóstico en caso de mejoría sintomática[24]. Los antibióticos usados, dosis y eficacia se reflejan en la tabla 2[4]. Hay que tomar con cautela estos datos, en especial los de eficacia, pues en muchos casos se basan en resultados de estudios con escasos pacientes.
Tabla 2
Antibióticos y dosis usadas en sobrecrecimiento intestinal.
Con la rifaximina es con la que vamos a contar con estudios más amplios y de mayor calidad, extrapolados de trabajos sobre el SII subtipo diarrea. Se trata de un derivado sintético de la rifampicina, siendo un antibiótico de amplio espectro, con actividad frente a aerobios y anaerobios. La absorción intestinal que va a presentar es mínima, menor de 4 %. Tiene varios mecanismos de acción: inhibe la síntesis de ARN bacteriano, presenta efecto bactericida-bacteriostático, disminuye la respuesta inflamatoria, reduce la expresión de citoquinas y presenta un efecto eubiótico[25]. Se encuentra avalada por estudios fase III que demostraron su eficacia en pacientes con síndrome de intestino irritable subtipo diarrea y que llevaron a la FDA a autorizar su uso en éstos, recomendando también su utilización la última guía clínica publicada por la Sociedad Europea de Neurogastroenterología y Motilidad[25]. En este estudio se evidenciaba que los pacientes que recibían 550 mg, tres veces al día durante 14 días de rifaximina mostraban mayor mejoría, tanto en la puntuación global de los síntomas, como en hinchazón abdominal, frente a aquellos que recibían placebo[26].Además, otro estudio fase III, continuación del anterior, mostró que volver a tratar a los pacientes que habían respondido inicialmente pero recidivaban con el tiempo era eficaz frente a placebo en la respuesta global y mejoría del dolor abdominal, aunque no así en la respuesta a la diarrea[27]. Uno de los pocos meta-análisis que analiza el uso de rifaximina en el SBI muestra una tasa de erradicación global del 70,8 %, siendo similar en pacientes con SII (71,6 %). En el análisis de regresión logística sólo resultó significativo una dosis de 1.200 mg diaria o superior. En los 10 estudios que evaluaban la respuesta sintomática, el 67,7 % de los pacientes que erradicaban el SBI mejoraban sintomáticamente[28]. Otro meta-análisis más reciente muestra una erradicación del 59 % por intención de tratar y del 63 % por protocolo, siendo ésta dosis-dependiente, encontrando con 1.600 mg diarios la máxima tasa de erradicación y sin encontrar diferencias con diferentes duraciones del tratamiento[29]. En cuanto a los efectos secundarios la mayoría de los estudios muestran que son escasos, similares a placebo y sin prácticamente casos de infección por C.Difficile[26],[28]. Un trabajo reciente mostró que los pacientes con SII subtipo diarrea que presentaban un test de lactulosa positivo para SBI tenían una mayor mejoría sintomática tras el tratamiento con rifaximina respecto a aquellos en los que el test de aliento era negativo, siendo además, mayor en aquellos que negativizaban un test inicialmente positivo[30].
Con el resto de antibióticos vamos a encontrar una evidencia científica menor, con trabajos que incluyen un menor número de pacientes. Un estudio europeo mostró que la rotación de un antibiótico tipo azol con quinolona era superior a un tratamiento único con alguno de ellos[31]. Igualmente parece que la combinación de rifaximina y neomicina es superior al tratamiento único para tratar el sobrecrecimiento intestinal metanogénico[32].
Conclusiones. Líneas Futuras.
El SBI es una causa reconocida de malabsorción en pacientes con alteraciones anatómicas que generan estasis intestinal. Es importante considerarlo también en casos de edad avanzada y diabéticos, sobre todo en presencia de diarrea y datos de malabsorción. Puede ser muy frecuente en pacientes con esclerodermia, debido a las severas alteraciones en la motilidad intestinal que genera esta enfermedad. Se debe tener también en cuenta en pacientes celíacos y con enfermedad de Crohn que tengan una respuesta terapéutica inadecuada. Los estudios muestran que el SBI es más frecuente en pacientes con SII y puede jugar un papel en la etiopatogenia de algunos de ellos. El problema es que los test diagnósticos que usamos para llegar a estos casos tienen un rendimiento diagnóstico limitado, con una baja sensibilidad y especificidad, sobrediagnosticando muchos casos, lo cual supone prescribir tratamientos con antibióticos de forma innecesaria. No se dispone de evidencia científica consistente para recomendar su investigación sistemática en estos pacientes, aunque podría plantearse en aquellos con SII subtipo diarrea, descartando otras posibilidades y con mala respuesta terapéutica, así como en casos de SII subtipo estreñimiento para investigar la presencia de sobrecrecimiento intestinal metanogénico.
Posiblemente para evaluar el verdadero impacto que pueden tener las disbiosis y el SBI, sería importante definir cuál sería el microbioma de los pacientes "sanos", lo cual no es fácil, pues este microbioma "normal" puede variar en diferentes individuos. Parece haber más similitudes en la metatranscriptómica (expresión genética de una comunidad bacteriana) y en la metabolómica (conjunto de pequeñas moléculas y metabolitos producidos por la comunidad bacteriana), que van a condicionar una función microbiana "normal", con ciertas funciones y capacidad de resistencia a estímulos externos. El objetivo del tratamiento sería, por tanto, restaurar una adecuada interacción simbiótica microbioma-huésped[5].

 Descargar número completo
Descargar número completo Download full issue
Download full issue