CITA ESTE TRABAJO
Valdés Delgado T, Argüelles Arias F, Guerra Veloz MF, Merino V, Belvis Jiménez M, Castro Laria L, Maldonado Pérez B, Perea Amarillo RE, Caunedo Álvarez Á. Estudio piloto sobre la utilidad de la monitorización de niveles y anticuerpos anti-infliximab en pacientes con Enfermedad Inflamatoria Intestinal en práctica clínica. Estudio "Inflixilevel". RAPD Online. 2018;41(2):68-72.
Introducción
La enfermedad inflamatoria intestinal (EII) es un desorden crónico autoinmune caracterizado por una inflamación intestinal recidivante. Además de presentar un gran impacto en la calidad de vida, la enfermedad de Crohn (EC) y la colitis ulcerosa (CU) son patologías frecuentes, con una alta prevalencia en España[1]. En la última década la incidencia de la EII en Andalucía se ha duplicado y es similar a la del resto del país y Europa[2].
No se conoce con exactitud su etiopatogenia, si bien una de las citocinas más involucradas en la cascada inflamatoria es el factor de necrosis tumoral-α (TNF-α). Se sabe que es un mediador del sistema inmune y un potente inductor de inflamación en la EII y otras enfermedades como la psoriasis, artritis reumatoide y espondilitis anquilosante. Su producción excesiva puede exacerbar estas enfermedades, por lo que el desarrollo de fármacos que lo inhiben supone un avance terapéutico muy importante[1], [3]. No todos los anti-TNF son iguales, la mayoría son anticuerpos monoclonales y se dividen en dos grupos: los de la clase IgG1 como infliximab (anticuerpo monoclonal quimérico, 25% murino), adalimumab y golimumab (anticuerpos monoclonales totalmente humanos) y aquellos constituidos por un fragmento de anticuerpo como el certolizumab[4]. Estos fármacos tienen la ventaja de no poseer toxicidad intrínseca ya que se desdoblan en aminoácidos, pero sí la desventaja de presentar inmunogenicidad porque casi todas las proteínas terapéuticas inducen una respuesta de anticuerpos contra ellas, ya que el organismos las detecta como moléculas extrañas[1], [3]. Las consecuencias clínicas de esta formación de anticuerpos (denominados anticuerpos anti-drogas [ADA] o anticuerpos anti-medicamentos) varían según el tipo de anticuerpo presente. Así se han descrito dos tipos de anticuerpos: los anticuerpos neutralizantes que son aquellos que se unen al sitio activo del fármaco, inhibiendo su función y neutralizándolo. La consecuencia de esto es que la eficacia puede verse disminuida y llevando al fallo terapéutico[3], [5]. Y los anticuerpos no neutralizantes que son los que se unen al fármaco pero sin neutralizarlo. En este caso pueden formar inmunocomplejos que cambian la farmacocinética del fármaco afectando así a su eficacia terapéutica[3], [5].
La presencia de ADA frente a los diferentes anti-TFN es variable, siendo del 25,3% para infliximab (IFX), 12,7% para adalimumab, 3,8% para golimumab y 1,2% para etanercept[6].
El tratamiento biológico dirigido a anti-TNF es el más empleado en la práctica clínica y la experiencia acumulada durante casi dos décadas ha obtenido muy buenos resultados. Sin embargo, hasta en un 15-20% de los casos existe un fallo primario (no se consigue respuesta tras la dosis de inducción) y en un 20-25% fallo secundario (pérdida de la respuesta tras haberla obtenido durante un tiempo)[7]. A día de hoy, alrededor de un 30% de los pacientes precisan la toma de estos fármacos biológicos[2], lo que supone un 10-15% del consumo total de medicamentos en los hospitales[8].
Con el paso del tiempo y su uso tan amplio, se han conseguido implementar medidas que mejoran los resultados, como dosificar su administración según esquemas prediseñados y no a demanda, o añadir inmunosupresores. Así, la medición de los niveles séricos de IFX y anticuerpos anti-IFX parece conseguir una monitorización terapéutica individualizada añadiendo un parámetro objetivo a la clínica y adaptando la cantidad de fármaco a la respuesta del paciente, consiguiendo con ello optimizar al máximo el tratamiento[9]. A pesar del gran consumo que representa, la monitorización de sus niveles no está incorporada en muchos hospitales de forma sistemática a la práctica clínica. No obstante, hay ya estudios que han demostrado que una estrategia basada en la monitorización de estos niveles (los niveles séricos de fármaco en el valle se relacionan con respuesta clínica en la mayoría de los casos) es más efectiva que un tratamiento empírico, y sin un impacto negativo en la eficacia[9]-[12].
Desde hace algunos meses disponemos de la infraestructura para medir niveles de IFX en nuestro hospital. Por ello, el objetivo de nuestro estudio es pilotar, según práctica clínica, la utilidad de la medición de niveles y anticuerpos de IFX en nuestro centro.
Material y métodos
Se trata de un estudio piloto, observacional y prospectivo constituido por una cohorte de pacientes con EII en tratamiento con IFX. Se realizaron, de forma rutinaria, entre 2 a 3 mediciones de los niveles valle del fármaco y sus anticuerpos en suero. La medición de los niveles se realizó a todos los pacientes en tratamiento con IFX de forma consecutiva, sin seguir un esquema definido de medición (se medían niveles cuando acudían a recibir su tratamiento). Sólo los pacientes que iniciaban el tratamiento, tenían un esquema definido (se les midió a la semana 14, tras la dosis de inducción, y posteriormente a las semanas 22 y 30).
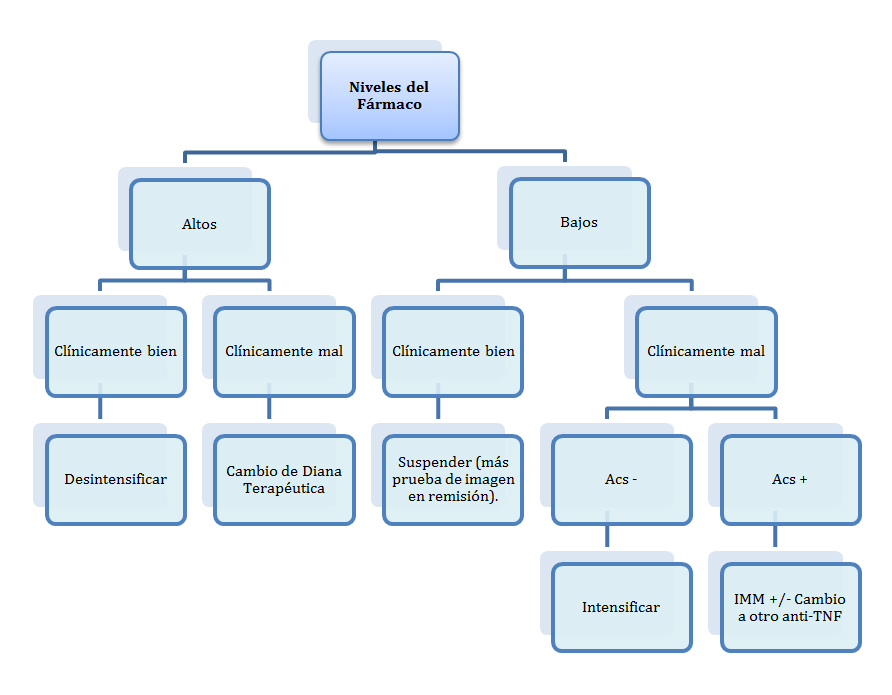
La muestra de suero de los pacientes la obtenía la enfermera de la unidad de día, el mismo día que el paciente iba al hospital a infundirse IFX, de esta forma se medía la cantidad mínima de fármaco en sangre, los considerados como niveles valle. Los ADA sólo se midieron cuando la concentración de niveles de IFX en sangre era menor de 0,01 mcg/ml. Para la medición se utilizó el test de ELISA que consiste en un inmunoanálisis antígeno-anticuerpo, concretamente el Kit PROMONITOR©, en la farmacia del hospital. Éste es fácilmente reproducible en los laboratorios de inmunología y/o bioquímica. Se ajustó la terapia según el algoritmo propuesto en el estudio TAXIT[7] (rango terapéutico aceptado 3-7 mcg/ml) y la clínica del paciente (Figura 1). Además de los niveles de IFX y los ADA en correlación con la clínica del paciente, otras variables estudiadas fueron edad (criterio de inclusión mayores de 14 años), sexo, peso, enfermedad (EC o CU), clasificación de Montreal y afectación perianal. Se determinó que la intensificación se podía realizar acortando tiempo entre infusiones o bien aumentando dosis (intensificación por tiempo: 5 mg/Kg cada seis o cada cuatro semanas; intensificación por dosis: 7,5 mg/Kg ó 10 mg/Kg cada ocho semanas) y la desintensificación se consideró como la administración del fármaco cada diez semanas.
Resultados
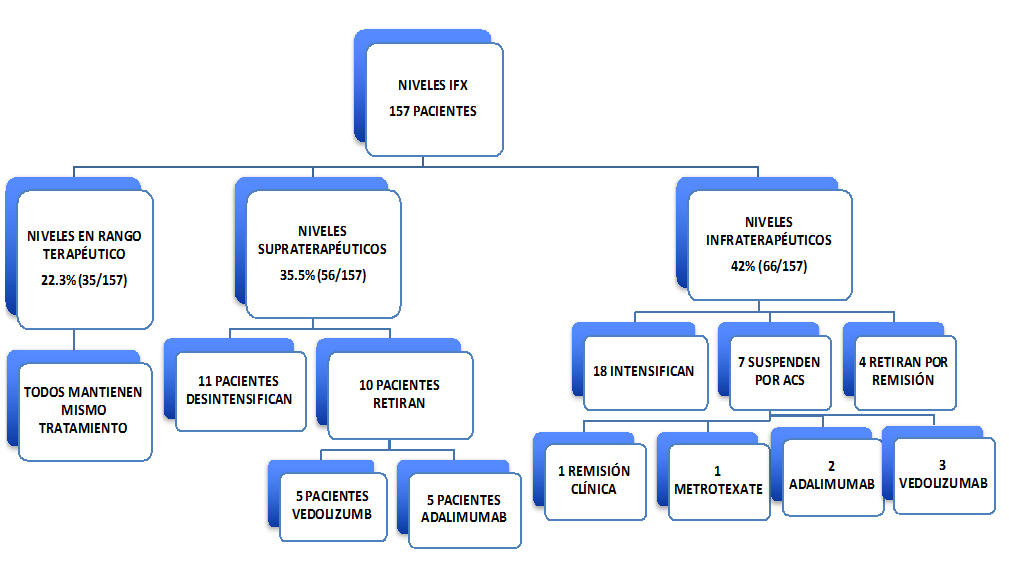
Se incluyeron 157 pacientes, un 56,6% (86/157) eran hombres con una edad media de 40,5±13,07 años. El 65,6% presentaban EC (103/157) y el 33,7% CU (53/157). El 33,7% (53/157) presentaban afectación perianal. En la mayoría de los casos, un 75,7% (119/157), se disponían de dos determinaciones. En un 22,3% (35/157) de los casos, los niveles estaban en rango terapéutico, media de 4,4±1,2 mcg/ml. En todos estos casos se decidió mantener el tratamiento (misma dosis y mismo intervalo), ya que estaban en remisión. En un 35,7% (56/157) de los pacientes, los niveles estaban por encima de los considerados apropiados (12,9±5,2 mcg/ml). De estos, once pacientes desintensificaron el tratamiento por encontrarse clínicamente bien y a diez se les cambió de tratamiento, cinco pasaron a vedolizumab y los otros cinco cambiaron a adalimumab, según el algoritmo en esta situación está establecido cambio de diana terapéutica, es decir, optar por otro fármaco con un mecanismo de acción diferente, que no sea bloquear el TNF, pero en nuestro caso, cinco de ellos cambiaron a adalimumab (anti-TNF) por presentar manifestaciones extraintestinales o bien por decisión propia, prefiriendo una administración subcutánea y no intravenosa. En un 42% (66/157) los niveles estaban en rango infraterapéutico (1±0,9 mcg/ml). De ellos, en 18 casos (11,5%) se decidió intensificar tratamiento por no estar en remisión clínica. En siete pacientes se suspendió IFX por desarrollar anticuerpos (anticuerpos neutralizantes) y se cambió de tratamiento, y en cuatro casos se retiró el tratamiento por remisión clínica mantenida (tanto clínica como de la mucosa).
En cuanto a reacciones adversas cuatro suspendieron el tratamiento, tres de ellos por prurito y reacción urticariforme y el restante por infección recurrente (herpes). En resumen y, según la actitud terapéutica tomada, la mayoría de los pacientes mantuvieron IFX a la misma dosis, cinco retiraron IFX, 18 intensificaron IFX, once desintensificaron IFX y 16 cambiaron de tratamiento (diez pacientes por niveles supraterapéuticos y seis pacientes por formación de ADA). Ver flujograma de actuación (Figura 2).
Discusión
Nuestro estudio pretende analizar los resultados iniciales tras la implementación de la medición de los niveles en los pacientes con IFX y valorar si la optimización del tratamiento mediante la determinación de los niveles de IFX y sus anticuerpos es útil y aplicable en la práctica clínica. Esta determinación añade, al manejo habitual de los pacientes con EII, un parámetro objetivo para individualizar el ajuste de los tratamientos terapéuticos[13]. El principal objetivo de esta medición es evitar que el paciente sea expuesto a cambios terapéuticos que no sean eficaces, lo que conlleva por un lado, una pérdida de tiempo en su proceso de tratamiento y por otro, un gasto farmacológico innecesario[14].
De nuestros resultados debemos destacar que menos de 1/3 de los pacientes con IFX están en rango terapéutico, algo llamativo, y que más del 40% están en rango infraterapéutico. Estos datos no son similares a los de otros estudios[9]-[12] y no encontramos una explicación razonable para ello. En cualquier caso, es cierto que todos nuestros pacientes con niveles en rango estaban controlados desde el punto de vista clínico, por lo que no se consideró ningún cambio. No obstante, en cincuenta casos se decidió algún cambio terapéutico, no sólo en función de los niveles sino también apoyados en la clínica. Esta decisión no la hemos podido analizar en este estudio preliminar pero sin duda, se debe valorar, y es nuestro siguiente objetivo, si esta medida ha resultado más eficaz o no. Sí podemos comentar que de los diez paciente con niveles supraterapéuticos, en cinco casos se cambió a vedolizumab, consiguiéndose respuesta en dos de ellos. Y de los otros cinco que fueron cambiados a adalimumab tres han conseguido respuesta. Evidentemente, estos resultados son muy preliminares y no se pueden sacar conclusiones. Además, no se decidió actuar en todos los pacientes con niveles fuera de rango, ya que lo que pretendíamos era tener una fotografía de cuál era la distribución de nuestros pacientes en función de los niveles y utilizar esta medición como apoyo para la toma de decisiones terapéuticas, sobre todo, en los pacientes con pérdida de respuesta. Desde nuestro punto de vista y a raíz de estos resultados iniciales, donde es más evidente que se deben medir los niveles es en este grupo de pacientes. Y si se decide medir niveles en todos los pacientes, parece claro que aquellos con niveles supraterapéuticos o con niveles no detectables y que estén controlados, se pueden beneficiar de retirar o desintensificar tratamiento[15], [16].
Es cierto que las guías internacionales de EII recomiendan empíricamente intensificación de tratamiento ante fracaso terapéutico primario o secundario[17], si bien, cada vez más se han ido teniendo en cuenta otros factores como datos analíticos o endoscópicos y, últimamente, la medición de niveles, añadiendo a la práctica clínica habitual un parámetro objetivo para individualizar el ajuste de los tratamientos terapéuticos. No obstante, destacar que en nuestro estudio teóricamente se debería haber cambiado la actitud en todos los pacientes con niveles supra e infraterapéuticos, que son 122, pero en la práctica clínica se han hecho en menos porque los niveles del fármaco no tienen por qué ser determinantes, son una herramienta objetiva más que nos ayuda a los clínicos de cara a la toma de decisiones terapéuticas en los pacientes con EII.
Nuestro estudio presenta varias limitaciones importantes. Al tratarse de un estudio en práctica clínica, algunas decisiones terapéuticas se han ido implementando según el investigador sin ajustarse en algún caso al protocolo establecido, lo que supone una desviación del mismo que debe ser analizado al finalizar el estudio. Además, para conseguir una actuación más efectiva que la aquí expuesta (ya que la valoración clínica ha sido a criterio del investigador), hay que combinar la cuantificación de los niveles junto con parámetros clínicos objetivos (CDAI/Harvey Bradshaw para EC, Mayo Score para CU) y valores analíticos como la PCR.
Conclusiones
En conclusión, con estos resultados, hemos obtenido una fotografía de cómo están nuestros pacientes distribuidos según niveles de IFX, destacando que menos de los esperados están en rango terapéutico. Hemos podido tomar decisiones en los pacientes en remisión clínica y con fallo a respuesta por lo que parece que la medición de niveles podría ser una medida eficaz en los pacientes con IFX en nuestra práctica clínica para optimizar el tratamiento. No obstante, nuestros resultados son absolutamente preliminares y se necesita conocer cómo han evolucionado los pacientes tras las decisiones adoptadas para concluir si es realmente útil o no.

 Descargar número completo
Descargar número completo Download full issue
Download full issue