CORRESPONDENCIA
Francisco Valverde López
Hospital Univeristario Virgen de las Nieves
Avda. de las Fuerzas Armadas, 2
18014 Granada
Introducción
La pancreatitis aguda (PA) constituye una de las principales causas de hospitalización en el ámbito de la Gastroenterología[1]. Si bien la mayoría de los casos presenta un curso leve y se resuelve en unos 3-5 días, hasta un 25% de los casos en algunas series desarrolla un episodio grave, caracterizado por fallo orgánico persistente, con un riesgo de mortalidad de entre el 36-50% cuando este se desarrolla en los primeros días del episodio[2]. Es más, ciertos estudios establecen que en pacientes graves, la presencia de necrosis infectada como complicación del episodio dispara aún más la mortalidad del mismo[3].
Aunque se ha producido un aumento de incidencia tanto de PA como de episodios graves de la misma, un análisis reciente ha puesto de manifiesto que la mortalidad ajustada por fallo orgánico es menor, sugiriendo una mejora en el manejo del cuadro[4]. Si bien los avances en este campo son múltiples, llama la atención la reciente tendencia a realizar un abordaje escalonado (Step-up) y mínimamente invasivo de las complicaciones locales de la PA, en concreto de la necrosis infectada y de aquellas colecciones (pseudoquistes y necrosis encapsuladas) que producen síntomas por compresión[5]. Actualmente, los procedimientos mínimamente invasivos consisten en el drenaje guiado por radiología o ecoendoscopia (USE) como primer escalón seguidos de necrosectomía mediante desbridamiento quirúrgico video asistido por abordaje retroperitoneal o necrosectomía endoscópica respectivamente en caso de no resolución tras los primeros. De entre ellos, el abordaje endoscópico está cobrando un papel protagonista, ya que en ciertos estudios ha demostrado presentar una menor tasa de fístula pancreática con similares cifras de mortalidad que el abordaje percutáneo[6]. No obstante, el manejo de un cuadro de PA de este calibre es una situación compleja y los abordajes mínimamente invasivos presentan a su vez una serie de complicaciones no despreciables que pueden poner en riesgo la vida del paciente, siendo por ello necesario un abordaje multidisciplinar. A continuación, presentamos un caso que ilustra tan compleja situación clínica.
Caso clínico
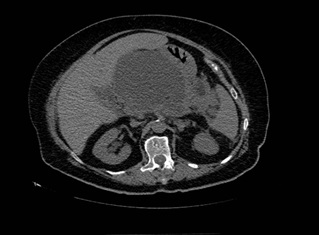
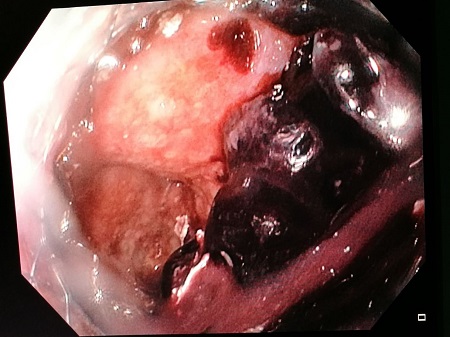
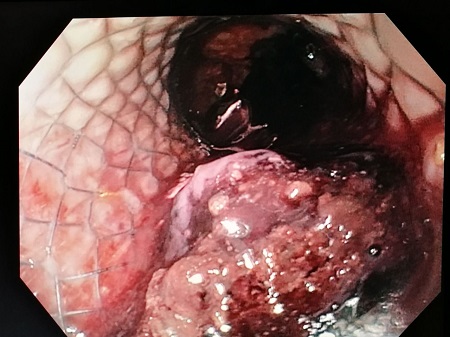
Mujer de 81 años que ingresa por cuadro de pancreatitis aguda litiásica BISAP 2 con evolución tórpida durante su estancia, desarrollando picos febriles y elevación de los parámetros inflamatorios sin foco extrapancreático aparente. Se realizó un TAC abdomino-pélvico que mostraba una colección peripancreática de 18x8,2x12,2 cm (Figura 1), desconexión del ducto pancreático, necrosis glandular del 50% y obstrucción completa de la vena esplénica, iniciándose antibioterapia de amplio espectro. Ante la no mejoría del cuadro, a las ocho semanas del debut del mismo, se procedió al drenaje vía transgástrica de la colección guiado por ecoendoscopia mediante punción de colección con aguja de 19 G paso de guía de 0m035, posterior dilatación de la pared con balón hidroneumático de dilatación biliar de 10 mm x 4 cm y colocación de prótesis metálica totalmente recubierta con forma de diábolo de 16x40 mm y a su vez al drenaje de colección hepática vía percutánea guiada por radiología. A pesar de ello, persistió mala evolución clínica y en nuevo TAC se observó prótesis en cavidad gástrica sin comunicación con la colección y pigtail fuera de la colección hepática. Se realizó nuevo drenaje transgástrico guiado por USE unas dos semanas después del anterior con retirada de la prótesis previa y colocación de nueva prótesis metálica de las mismas características que la anterior y de drenaje nasoquístico con paso de suero salino fisiológico. En el cultivo del material de la colección crecieron gérmenes gram negativos, gram positivos y hongos (Candida glabrata) por lo que se indica tratamiento con linezolid, meropenem y fluconazol en espera de antibiograma. Tras el mismo, la paciente experimentó una mejoría clínica importante derivándose al alta hospitalaria. Una semana después, acudió a urgencias por vómito hemático, melenas e hipotensión. Se procedió a la realización de una endoscopia digestiva alta urgente con evidencia de abundantes restos de sangre fresca en cámara gástrica que procedían de la celda pancreática evidenciándose en el interior de la misma un gran coágulo sin sangrado activo (Figuras 2 y 3). Se realizó de inmediato Angio-TAC sin signos de hematoma intraabdominal ni de sangrado activo. A la mañana siguiente la paciente presentó un cuadro de hematemesis con shock hipovolémico, siendo intervenida quirúrgicamente, con evidencia de sangrado de arteria esplénica que se trató exitosamente y se procedió a la retirada de la prótesis. Posteriormente, la paciente evolucionó de manera favorable sin nuevos episodios de sangrado, siendo dada de alta.
Discusión
El manejo endoscópico de la necrosis infectada ha supuesto un cambio radical en los últimos años. Si bien anteriormente se consideraba que aquellos pacientes con presencia de necrosis infectada o necrosis estéril sintomática, precisaban cirugía urgente, actualmente es conocido que un importante número de casos serán resueltos con un manejo conservador y antibioterapia en el primer caso, evitando por ello procedimientos invasivos que conllevan un riesgo no desdeñable de mortalidad[7],[8]. No obstante, el abordaje conservador debe reservarse para pacientes relativamente estables en los cuales se debe preconizar una monitorización estrecha, pasando a un un abordaje mínimamente invasivo en caso de deterioro clínico o ante la ausencia de mejoría[5]. Actualmente, disponemos de una gran variedad de procedimientos que permiten un amplio abanico terapéutico en tan complicada situación. No obstante, es preciso un entrenamiento previo en las mismas, de tal modo que sólo deben ser llevadas a cabo por personal experto en centros especializados. Estos abordajes vienen constituidos por la cirugía laparoscópica (abordaje anterior o retroperitoneal), percutáneo (drenaje o necrosectomía por catéter guiado radiológicamente), desbridamiento video asistido retroperitoneal izquierda (VARD) y endoscópico[5]. Independientemente del abordaje que se realice, estos requieren que la necrosis pancreática esté organizada, lo cual suele suceder a las cuatro semanas tras el debut de la enfermedad[9]. El uso de estos procedimientos de forma secuencial por personal experimentado, ha demostrado ampliamente reducir las tasas de mortalidad en este grupo de pacientes con respecto a la cirugía abierta tradicional[6],[9]. En 2013, se puso en marcha el estudio TENSION, un ensayo clínico multicéntrico aleatorizado en el que se comparaba un abordaje quirúrgico secuencial mínimamente invasivo frente a un abordaje endoscópico también secuencial. En ambos brazos, se realizaba primero un drenaje de la colección y posteriormente necrosectomía en caso de no mejoría. Los resultados de dicho estudio han salido a la luz muy recientemente, evidenciándose que no hay diferencias estadísticamente significativas en términos de mortalidad en ambos brazos, pero sí se ha observado una menor estancia hospitalaria y menor tasa de fístula pancreática en el brazo endoscópico[10],[11]. A la vista de estos resultados, no se puede decir que ninguno de los dos abordajes sea superior al otro y probablemente, la experiencia de cada centro sea decisiva a la hora de tomar decisiones. En el caso que presentamos se realizaron tanto un drenaje endoscópico de la colección peripancreática como un abordaje percutáneo de la colección hepática, dado que esta no era abordable endoscópicamente. La decisión de incluir el abordaje endoscópico estriba en la experiencia de nuestro centro, en el cual se prefiere la necrosectomía endoscópica a la quirúrgica, en caso de ser necesaria. Muy recientemente, Nemoto et al. han publicado una serie en la que se presenta un algoritmo secuencial basado principalmente en el uso de terapias endoscópicas que se combinaban con abordajes percutáneos en caso de ser necesario, con buenos resultados y escasa necesidad de cirugía abierta[12]. Si bien el drenaje de colecciones pancreáticas ha demostrado ser una técnica segura, como todo procedimiento, no está exento de complicaciones, habiéndose determinado un mayor índice de las mismas en varias series en caso de infección de la colección[13],[14]. Las principales complicaciones evidenciadas son la perforación, el sangrado, la infección y la migración del stent[15].
La mayoría de las perforaciones descritas en las series reportadas ocurren durante la punción transmural de la colección mediante el uso del electrocauterio[15]. En general, se recomienda el uso tanto de la imagen ultrasonográfica como de la imagen fluoroscópica para guiar el procedimiento, así como el uso de CO2 para disminuir el impacto de una eventual perforación en caso de que esta suceda. La mayoría de las perforaciones son de pequeño tamaño y pueden ser manejadas de forma conservadora con drenaje nasogástrico y antibioterapia intravenosa, pasando a cirugía en caso de empeoramiento o no resolución del cuadro[15].
Con respecto al sangrado, a pesar del uso del doppler durante el procedimiento, constituye una complicación que puede acontecer tanto en el sitio de punción como en el interior de la cavidad. En ocasiones el sangrado se precipita tras una rápida descompresión del pseudoquiste[15]. La valoración de los parámetros de coagulación antes del procedimiento, así como la retirada de antiagregantes derivados de las tienopiridinas es esencial. Desde el punto de vista endoscópico, el sangrado inmediato puede ser tratado mediante la inyección de adrenalina diluida, taponamiento con balón, colocación de clips hemostáticos o la colocación de un stent metálico autoexpandible completamente recubierto entre otras medidas[15]. Es esencial a su vez valorar la presencia de un pseudoaneurisma como posible fuente de sangrado, lo cual puede ser confirmado con la realización de un TAC con contraste intravenoso. En este caso, una embolización mediante arteriografía transarterial o la cirugía pueden ser necesarias[16]. Si bien el sangrado periprocedimiento es la preocupación principal en los texto sobre esta materia, el sangrado diferido no debe ser infravalorado. En una serie publicada en Endoscopy en 2005, en la que se trata de evaluar los resultados a corto y largo plazo de 92 pacientes, se observó hemorragia en cuatro casos, de los cuales, tres se achacaron a la erosión de la pared del pseudoquiste a causa de la endoprótesis[17]. En el caso que presentamos, si bien no se observó alteración vascular mediante el Angio-TAC, la cirugía evidenció un sangrado procedente de la arteria esplénica que fue tratado exitosamente.
En conclusión, si bien es claro que la estrategia escalonada, mediante un abordaje mínimamente invasivo es superior a la cirugía abierta tradicional, éste no está exento de complicaciones[6],[9]. En concreto, la perforación, el sangrado, la infección y migración del stent son las más relevantes dentro del procedimiento endoscópico. Si bien el sangrado periprocedimiento puede ser manejado endoscópicamente, en ciertas ocasiones precisará de embolización o cirugía[15]. Poca literatura hace referencia al sangrado diferido, si bien algunas series barajan como agente causal del mismo la erosión de los vasos producida por la prótesis empleada para la cistogastrostomía[17]. Nuestro caso pone de manifiesto esta última posibilidad, precisando la paciente un tratamiento quirúrgico urgente durante el cual se solucionó el sangrado exitosamente y se procedió a la retirada de la prótesis, con resolución del cuadro.

 Descargar número completo
Descargar número completo Download full issue
Download full issue