Introducción
El trasplante hepático (TH) ha experimentado una rápida evolución en las últimas décadas, hasta convertirse hoy en día en el tratamiento de elección para distintas enfermedades hepáticas tanto agudas, como crónicas, una vez agotadas otras alternativas terapéuticas, o cuando la esperanza de vida sin él sea inferior a la prevista con el trasplante[1]. En nuestro país, el número de trasplantes hepáticos ha ido en aumento en los últimos años, siendo el índice de trasplante por millón de habitantes uno de los más elevados (22,8), junto con Bélgica (26,3), Portugal (22,7) y Estados Unido (20,2)[2].
Sin embargo, y a pesar del beneficio que supone el TH en términos de supervivencia y calidad de vida, éste no está exento de complicaciones derivadas tanto del propio acto quirúrgico, como del tratamiento inmunosupresor a largo plazo. Todo esto, junto con el desequilibrio existente entre el número de órganos disponibles y el número de posibles receptores que se encuentran en lista de espera[2], hace que sea necesaria una estricta selección de los pacientes para asegurar que, en cada caso, el TH es la mejor alternativa terapéutica para el paciente.
Las indicaciones para el TH son muy variadas y han ido modificándose y creciendo en los últimos años. De manera general, el TH debe considerarse en todos aquellos pacientes con hepatopatía avanzada en los que la esperanza de vida sin trasplante es inferior a un año o en aquellos casos en los que la calidad de vida de los pacientes se vea muy afectada como consecuencia de dicha enfermedad hepática[1].
Las indicaciones del TH electivo pueden clasificarse en:
a) Indicaciones generales o convencionales: aquellos trasplantes realizados por insuficiencia hepatocelular generalmente debido a una hepatopatía crónica avanzada. La priorización de estos pacientes en la lista de espera se hace en función de la puntuación MELD[1].
b) Indicaciones especiales de TH, o excepciones al MELD (Figura 1) hace referencia a situaciones en las que (I) el sistema MELD no refleja la gravedad real del paciente, (II) la indicación del trasplante viene condicionada por un deterioro significativo de la calidad de vida, o (III) existe una neoplasia hepática. Este es el caso de la ascitis refractaria, la encefalopatía crónica, el prurito intratable y el hepatocarcinoma entre otros[1].
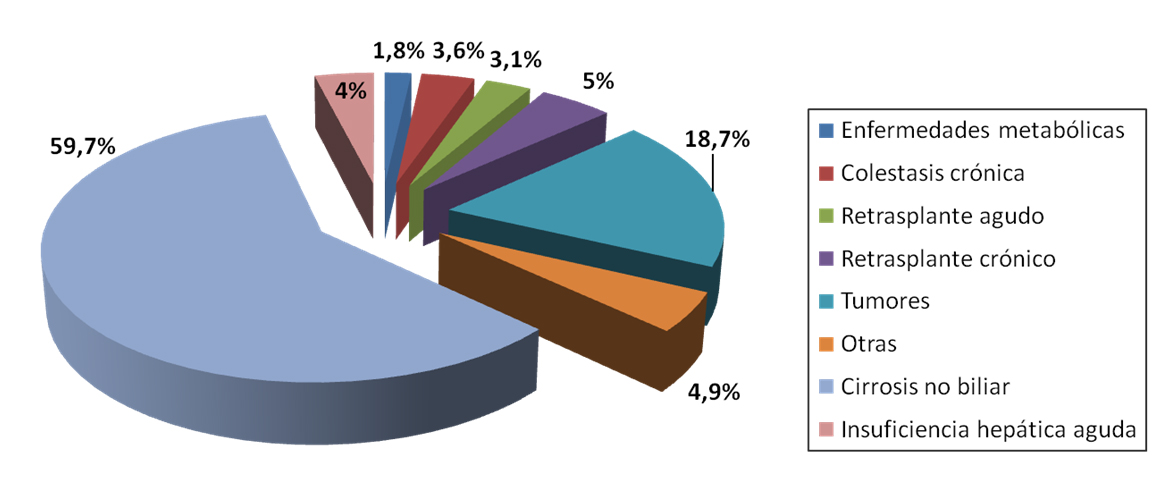
En nuestro país, la indicación más frecuente del TH electivo es la insuficiencia hepática secundaria a cirrosis hepática (59,7%), seguida de tumores hepáticos, fundamentalmente el carcinoma hepatocelular (CHC), que representa el 18,7% de los trasplantes hepáticos en nuestro medio. Otras causas menos frecuentes son el retrasplante, las enfermedades colestásicas crónicas, la insuficiencia hepática aguda, o las complicaciones derivadas de la hipertensión portal[2] (Figura 1).
Tumores hepáticos
La mejora en los resultados del TH ha motivado una revisión continua y extensión de sus indicaciones. Una de las indicaciones que aún está sometida a gran controversia es el papel del TH como tratamiento de los tumores hepáticos tanto primarios como metastásicos debido al riesgo de recurrencia. Como norma general, se asume el TH como tratamiento aceptable si la supervivencia esperada a 3 años es superior al 70%, lo cual hace que en la práctica, el TH se limite a casos seleccionados con hepatocarcinoma, hemangioendotelioma o metástasis de tumor neuroendocrino[3].
1. CARCINOMA HEPATOCELULAR
El carcinoma hepatocelular (CHC) es la neoplasia primaria hepática más frecuente y aparece generalmente sobre un hígado cirrótico. Representa la quinta neoplasia más frecuente y la segunda causa de muerte debida al cáncer a nivel mundial, siendo además una de las indicaciones más comunes de TH[2], [4]. El TH como tratamiento del CHC permite, no sólo la curación de la enfermedad tumoral, sino también la de la enfermedad hepática subyacente. Los resultados iniciales obtenidos con el TH en este grupo de pacientes no fueron alentadores, obteniéndose elevadas tasas de recurrencia y baja supervivencia (18%-40%), por lo que durante años la presencia de CHC se consideró una contraindicación para el TH. Fue en el año 1996 cuando Mazzaferro et al.[5], publicaron los resultados obtenidos en un estudio en el que analizaron prospectivamente una cohorte de 48 pacientes con CHC pequeño e irresecable sometidos a TH. Aquellos pacientes que cumplían las siguientes condiciones: un nódulo menor de 5 cm o hasta tres nódulos con menos de 3 cm cada uno de ellos (en ausencia de afectación macrovascular o extensión extrahepática) fueron sometidos a TH. Con estos criterios de selección, que posteriormente se denominaron Criterios de Milán, se obtuvieron excelentes resultados, con tasas de supervivencia a los 4 años del 75% y una tasa de supervivencia libre de enfermedad del 83%. Estos datos fueron reproducidos en otros múltiples grupos de TH a nivel mundial.
En los últimos años se han criticado los criterios de Milán por ser demasiado restrictivos. Es posible que algunos pacientes que sobrepasan estos criterios de forma discreta, puedan aún beneficiarse del TH con resultados similares en términos de supervivencia y recurrencia tumoral. Distintos intentos para expandir los criterios de Milán (Tabla 3) se han desarrollado en los últimos años: Criterios UCSF[6], Criterios de Asan[7], Criterios de Kioto[8], Criterios de la Universidad de Navarra[9], Criterios de Toronto[10] o los criterios "up-to seven"[11]. En general, implican un aumento del tamaño tumoral y/o número de nódulos permitidos, pero manteniéndose la contraindicación en casos de invasión vascular/metástasis. Aunque las tasas de recidiva tumoral son aceptables con todos estos sistemas, se incrementan de forma progresiva con la carga tumoral existente en el momento del trasplante. Este razonamiento dio lugar a la analogía del "metroticket": Cuanto más lejos se quiere viajar (en términos de expansión de criterios de Milán), mayor será el precio a pagar (en términos de recidiva tumoral y mortalidad). Por tanto, la mayoría de los grupos siguen utilizando los criterios de Milán, aunque en entornos con mayor disponibilidad de donantes o con utilización de donante vivo, probablemente sea recomendable utilizar criterios expandidos.
El CHC es la indicación que mejor representa la necesidad de un modelo de priorización específico paralelo al sistema MELD, ya que generalmente los pacientes con CHC presentan función hepática conservada, siendo la progresión de la enfermedad tumoral el principal condicionante de mortalidad. Los modelos de priorización más habituales tienen en cuenta aspectos relacionados con la carga tumoral (número de nódulos y tamaño de los mismos). Los pacientes acceden a la lista con una puntuación MELD basal empírica, y posteriormente van recibiendo puntos MELD extra (también empíricamente) conforme transcurre el tiempo en lista de espera. La asignación de puntos MELD varía en cada país e incluso entre diferentes programas de trasplante en el ámbito nacional. La experiencia inicial del modelo norteamericano, en el cual los pacientes con CHC accedían a la lista con una puntuación MELD basal de 22, y recibían 3 puntos MELD extra cada 3 meses en lista de espera, provocó un aumento desmesurado de trasplantes por CHC a expensas de las otras indicaciones[12]. Recientemente, el modelo americano ha sido modificado, y en la actualidad los pacientes con CHC acceden a la lista de espera con su MELD real (habitualmente bajo) y sólo se les asigna los 22 puntos MELD cuando pasan en lista 6 meses. Se ha mantenido la adición de 3 puntos MELD extra cada 3 meses de permanencia en lista a partir de los 6 meses. Este sistema asegura, por un lado, un tiempo en lista razonable para estos enfermos (sin perjudicar al resto de indicaciones), a la vez que se seleccionan para trasplante los pacientes con tumores que presentan un comportamiento biológico menos agresivo, y que responden favorablemente a terapias ablativas loco-regionales mientras permanecen en lista. En Andalucía, el modelo de priorización de pacientes con CHC se asemeja mucho al modelo implantado recientemente en Norteamérica. Los pacientes ingresan en lista con MELD=15 puntos, y en caso de tumores estadio T2 (nódulo único de 2-5 cm o presencia de 2-3 nódulos) o con alfafetoproteina (AFP) >200, se asigna 1 punto MELD extra cada mes de permanencia en lista. Cuando se alcanza una puntuación MELD de 18 el paciente accede a la lista preferente común y sigue recibiendo 1 punto extra cada mes en lista hasta un máximo de 23 puntos. Existen alternativas múltiples a estos modelos, ninguna de ellas suficientemente validadas. Pomfret et al.[13] propusieron una fórmula que incorpora la AFP, el MELD y el diámetro tumoral máximo; más recientemente, Toso et al.[14] han descrito un modelo pronóstico de riesgo de exclusión de lista que incorpora edad, diámetro tumoral, AFP y etiología de la hepatopatía. En este sentido, si bien el consenso norteamericano establecido en la MELD Exception Study Group Conference (MESSAGE) de 2006[15] solo consideraba los criterios morfológicos (CHC T2) para establecerla priorización, la conferencia de 2010 ya recomienda un modelo pronóstico basado en MELD, AFP, diámetro total de las lesiones y tiempo en lista cumpliendo criterios de Milán.
Sea cual sea el modelo de priorización seguido para pacientes con CHC, la realización de terapias ablativas loco-regionales es recomendable si el tiempo de permanencia en lista esperado es mayor de 6 meses, lo cual ocurre en la mayoría de los programas de trasplante. Con ello se consigue, no sólo evitar la progresión tumoral mientras el paciente espera un donante, sino también disponer de información sobre respuesta al tratamiento empleado, lo cual puede interpretarse como indicador de agresividad biológica del tumor. Finalmente, se debe insistir en una continua monitorización del funcionamiento del sistema de priorización de pacientes con CHC para detectar desigualdades en el acceso al trasplante entre diferentes indicaciones, y así poder adaptar el modelo a los cambios epidemiológicos y demográficos de la población de referencia.
2. COLANGIOCARCINOMA
El colangiocarcinoma (CC) representa la segunda neoplasia primaria hepática en frecuencia tras el CHC. Su incidencia ha ido en aumento en las últimas décadas. En Estados Unidos la incidencia es de entre 3.000 y 4.000 casos/año[16]. En función de su localización, el colangiocarcinoma se puede clasificar en intrahepático (5%-10%) o extrahepático (95%-80%) que a su vez se divide en hiliar (60%-70%), o distal (20%-30%)[17]. El tratamiento curativo de elección del CC tanto intra como extrahepático es la resección quirúrgica completa. Sin embargo, en el momento del diagnóstico sólo un 15%-35% de los pacientes presentan un tumor potencialmente resecable[18], y en los que se consigue una resección completa la tasa de recurrencia a los dos años es del 63%[18], [19].
El papel del TH en el tratamiento del CC es muy controvertido, debido a las altas tasas de recurrencia y bajas tasas de supervivencia a largo plazo obtenidas en las primeras experiencias. Meyer et al.[20] analizaron retrospectivamente los resultados obtenidos en 207 pacientes trasplantados hepáticos por CC, entre 1968 y 1997. Obtuvieron una tasa de supervivencia a los 5 años del 23% y una tasa de recurrencia tumoral del 51% que en su mayoría (84%) se produjeron en los primeros dos años tras el TH. En 2003 se publicó la experiencia obtenida en TH en CC (tanto intra como extrahepático) en varios centros españoles, estando sus resultados en línea con los anteriores, con tasas de supervivencia a los 5 años del 42% y del 30% para CC extrahepático e intrahepático respectivamente, y tasas de recurrencia del 35% para CC extrahepático y 53% para el CC intrahepático. Son múltiples las series publicadas con resultados similares, los cuales son francamente inferiores a los estándares mínimos exigibles en el ámbito del TH[20], [21]-[25]. Por todo ello, el CC se consideró clásicamente una contraindicación formal para el TH.
Los protocolos desarrollados en la Clínica Mayo[16] y en la Universidad de Nebraska[26] , en los que se empleaba tratamiento neoadyuvante con quimio y radioterapia, junto con laparotomía exploradora previa al trasplante, para descartar la presencia de afectación linfática o a distancia, demostraron buenos resultados en cuanto a tasas de supervivencia y recurrencia tumoral en los pacientes con CC hiliar con criterios de irresecabilidad. En el estudio de la Clínica Mayo[16], publicado inicialmente, seleccionaron 25 pacientes, 11 de los cuales fueron sometidos a TH, con una tasa de supervivencia del 92%. Sólo un paciente presentó recurrencia de la enfermedad tumoral. Este mismo grupo publicó posteriormente los resultados obtenidos en 38 pacientes con CC hiliar sometidos a TH comparándolos con un grupo control (26 pacientes con CC tratados mediante resección)[19], en él obtienen altas tasas de supervivencia a largo plazo en el grupo de pacientes trasplantados (82% a los 5 años), mayores que en grupo control (21%), así como una menor recurrencia (13% vs 27%). Sudan et al.[26], describen una supervivencia global del 45% con sólo dos recurrencias de la enfermedad. Siguiendo estos protocolos, otros autores han obtenido resultados similares[27]-[31]. En el año 2012 se publicaron los resultados del TH en CC en 12 centros de EE.UU.[32], siguiendo el protocolo de la clínica Mayo, incluyendo 287 pacientes con CC hiliar. Obtienen una tasa de supervivencia libre de enfermedad del 65% a los 5 años, una tasa de recurrencia del 25% y una tasa de progresión del 11,5% cada 3 meses.
Los resultados del TH en CC hiliar han ido mejorando desde la incorporación del protocolo de la clínica Mayo, y sugieren que pacientes altamente seleccionados[33] con CC hiliar no resecable en estadios precoces, podrían beneficiarse del TH[34], [35]. A pesar de todo, estos protocolos no están extendidos y deben restringirse a centros con experiencia, y dentro de protocolos de investigación[1].
3. TUMORES NEUROENDOCRINOS
Los tumores neuroendocrinos (TNE), son un grupo heterogéneo de tumores que se originan en distintas localizaciones, páncreas, tracto gastrointestinal y pulmones. Representan el 0,46% de todas las neoplasias malignas[17] y el 2%[36] de las neoplasias del tubo digestivo, con una incidencia en aumento en las últimas décadas (incidencia anual 5-7 cc/100.000 habitantes)[17].
En líneas generales son tumores que presentan un comportamiento muy variable, existiendo tumores de crecimiento lento con tasas de supervivencia a los 5 años del 75%-99%[17], y otros de curso más agresivo con supervivencias inferior al 30% sin tratamiento[17], [37], [38]. Entre 40%-80% de los TNE presentan metástasis en el momento del diagnóstico, siendo el hígado el órgano más frecuentemente afectado (40%-93%) seguido por las metástasis óseas (12%-20%) y pulmonares (8%-10%)[17, [38]. La presencia de metástasis hepáticas ensombrece el pronóstico de los pacientes con TNE. Aunque la resección de las metástasis hepáticas es el tratamiento de elección para estos pacientes, la resección con intención curativa (aquella que consigue eliminar >90% del volumen tumoral) sólo es posible en el 10%-25% de los pacientes[17], [36], [38] ya que generalmente son de distribución multifocal y bilateral. Aunque este tipo de resección con intención curativa aumenta la supervivencia en estos pacientes, la tasa de recurrencia es elevada (80% a los 5 años)[36]. Diversos autores han analizado los resultados del TH en este grupo de tumores con tasas de supervivencia que oscilan entre 30%-93%[21], [39], [55]. En una serie de 103 pacientes con metástasis hepáticas de TNE que se sometieron a TH, se obtuvieron tasas de supervivencia a los 5 años del 47%[56]. En otro estudio realizado sobre pacientes de la base de datos de la United Network of Organ Sharing (UNOS) incluyendo 133 pacientes sometidos a TH por TNE entre 1988-2008, se describieron tasas de supervivencia global al año, a los tres años y a los 5 años del 81%, 65% y 49% respectivamente y tasas de supervivencia libre del enfermedad del 32% a los 5 años[37]. Nguyen et al.[57] encontraron tasas de supervivencia del 57,8% en estos pacientes. En una revisión sistemática se analizaron conjuntamente resultados de 53 estudios, de los cuales 20 fueron incluidos en el análisis final, con 89 pacientes sometidos a TH por TNE[58]. Encontraron tasas de supervivencia global a los 5 años del 44%. En sucesivos estudios multicéntricos se describen tasas de supervivencia a los 5 años del 47% y 52%[55], [59], [60]. Aunque los resultados en términos de supervivencia global son favorables y no se presentan diferencias estadísticamente significativas en comparación con los obtenidos en el grupo de pacientes trasplantados por CHC, la recurrencia en los TNE es más elevada (31% vs 10%-15%)[37], de manera que las tasas de supervivencia libre de recurrencia a los 5 años oscilan entre 11% y 47%[37], [54], [57], [59], [61].
La definición de aquellos factores pronósticos que permitan una adecuada selección de los mejores candidatos para el TH es fundamental para mejorar los resultados en este tipo de tumores[62]. Algunos de los factores de mal pronóstico descritos son: edad >50 años, la presencia de afectación extrahepática en el momento del TH, la necesidad de realizar resecciones amplias del tumor primario, la afectación hepática de más del 50%, la localización del primario a nivel pancreática, los tumores carcinoides, tumores pobremente diferenciados o con alto grado de proliferación celular (Ki67>5%), la invasión de grandes vasos, la presencia de afectación linfática, y la presencia de hepatomegalia[37], [47], [52], [53], [55]-[64].
Se han propuesto unos criterios muy estrictos para seleccionar pacientes con metástasis hepáticas de tumor neuroendocrino, candidatos a beneficiarse de TH[47], [64] incluyendo enfermedad limitada al hígado, tumor primario identificado y resecado, histología de tumor bien diferenciado, tumor primario que drena al sistema portal, y extensión de la enfermedad hepática <50%, estable durante al menos 6 meses de seguimiento. Con estos estrictos criterios de selección, se han reportado tasas de supervivencia global y libre de enfermedad a los 5 años del 90% y 77% respectivamente. Aunque se ha criticado el hecho de que quizás sean criterios muy restrictivos, ya que, en otros centros, obtienen resultados similares, con criterios menos estrictos[50]-[52], [59]-[61], [64], [65].
Por lo tanto, el TH puede ser una buena opción para el tratamiento de aquellos pacientes seleccionados, con metástasis hepáticas de TNE. Sin embargo, dado que no existen ensayos clínicos que comparen el TH con otras opciones terapéuticas, y que la mayoría de los datos proceden de estudios retrospectivos sin validación externa, se necesitan más estudios para poder establecer exactamente qué pacientes se podrían beneficiar del mismo[38], [62].
4. HEPATOBLASTOMA
El hepatoblastoma (HB) es el tumor hepático primario más frecuente en la población pediátrica y representa aproximadamente el 80% de las neoplasias hepáticas en niños[17], [66]. Su incidencia ha ido en aumento en los EE.UU. en los últimos 30 años[67] y, aunque su etiología no es bien conocida, parece asociarse a enfermedades de base genética poco frecuentes (como la poliposis adenomatosa familiar y el síndrome de Becwith-Wiedman) así como al bajo peso al nacer. El pronóstico de este tumor ha ido mejorando a lo largo de las últimas décadas debido a la mejora en los regímenes quimioterápicos, la cirugía y los cuidados postoperatorios.
El papel del TH en estos tumores ha ido cobrando mayor relevancia en las últimas décadas, de manera que en el año 2010 representaba en EE.UU. el 7,5% de las indicaciones de TH en la población pediátrica[67]. El tratamiento de elección para estos pacientes se basa en la resección quirúrgica combinada con tratamiento quimioterápico. Se consiguen así tasas de supervivencia a los 5 años del 80%. Sin embargo, hasta un 60% de los pacientes tienen un tumor irresecable en el momento del diagnóstico[17]. Es en estos pacientes en los que el TH se convierte en la mejor opción terapéutica.
En 2002 la Sociedad Internacional de Oncología Pediátrica (SIOPEL) estableció que en aquellos pacientes con un HB irresecable, el TH asociado a quimioterapia previa es el tratamiento de elección. Ya que en estos casos la afectación vascular y la posibilidad de no conseguir una resección del tumor adecuada con márgenes libres condiciona un elevado riesgo de recidiva tumoral[68]. Con este esquema de tratamiento se han obtenido excelentes resultados. Las tasas de supervivencia libres de enfermedad oscilan entre 87%-75% a los 5 años[69]-[71]. McAteer[72] analizó los resultados de 318 pacientes diagnosticados de HB, de los cuales 53 (16,7%) fueron sometidos a TH con tratamiento quimioterápico previo, con tasas de supervivencia del 86,5% para aquellos pacientes en los que se realizó el TH y del 85,6% en los fueron tratados mediante la resección. Cruz et al.[67] describieron también tasas de supervivencia 85,7% a los 5 años. En los pacientes trasplantados por HB, las complicaciones vasculares (trombosis arterial) son más frecuentes que en los trasplantados por enfermedades no tumorales, probablemente en relación con el uso de ciertos quimioterápicos, sobretodo el cisplatino. No hay diferencias entre los dos grupos en cuanto a la incidencia del rechazo y supervivencia del injerto[72]-[74].
Se han descrito como factores predictores de supervivencia la presencia de enfermedad metastásica antes del TH y la ausencia de respuesta tumoral al tratamiento quimioterápico. También se han descritos mejores resultados en los pacientes sometidos a TH primario que aquellos sometidos a TH de rescate (supervivencia 82% vs 30% respectivamente)[69]. Es por esto que, en aquellos pacientes en los que la resección es compleja y previsiblemente incompleta, o en los que el tumor está cerca o afecta a grandes vasos, deba considerarse el TH como la mejor opción[69], [70]. En definitiva, aunque inicialmente se ha mantenido una actitud de reserva hacia el papel del TH en el tratamiento del HB, se trata de una buena opción terapéutica en aquellos pacientes con un HB no resecable. La presencia de enfermedad metastásica en el momento del diagnóstico no supone una contraindicación para el TH, siempre que responda a quimioterapia previa o que pueda ser resecada.
5. OTROS TUMORES HEPÁTICOS
Hemangioendotelioma: es una neoplasia maligna poco frecuente que se origina del endotelio vascular, afecta predominantemente a mujeres y su pronóstico es variable. El tratamiento de elección es la resección quirúrgica, sin embargo hasta en un 90% de los casos se presenta como un tumor multifocal, por lo que en estos casos el TH es la mejor opción de tratamiento con un pronóstico y resultados favorables[17]. Debido a que es una enfermedad poco frecuente, la mayoría de los datos disponibles proceden de series pequeñas de casos. Los resultados oscilan entre tasas de supervivencia del 83% al 55% a los 5 años, con cifras de supervivencia libre de enfermedad del 69% a los 5 años[75]-[78]. En este tipo de tumor, la afectación linfática, vascular o de enfermedad a distancia, no afectan a los resultados de supervivencia. Por ello, el TH es una buena opción para pacientes con hemangioendotelioma irresecable, incluso en aquellos pacientes con enfermedad a distancia[17].
Sarcoma hepático: e angiosarcoma es un tumor originado del endotelio de los vasos sanguíneos del hígado. A diferencia del hemangioendotelioma es un tumor muy agresivo, de crecimiento rápido con una supervivencia media de 6 meses. Es muy quimiorresistente y se han descrito resultados muy desfavorables tanto en la resección como con el TH, con supervivencias inferiores a 30 meses. En el registro europeo, la supervivencia media de 17 pacientes trasplantados por angiosarcoma es de sólo 7 meses, por lo que se considera una contraindicación para el TH[3], [79].
Metástasis de carcinoma colorrectal (CCR): El TH como tratamiento para las metástasis de CCR es aún controvertido. En un estudio piloto prospectivo realizado en Noruega[80] se obtuvieron tasas de supervivencia del 60% a los 5 años, con una tasa de supervivencia libre de enfermedad al año del 35%. Ningún paciente tuvo supervivencia libre de enfermedad a largo plazo. Por tanto, estos resultados deben ser interpretados con precaución sobre todo en una situación de escasez de órganos. Se ha puesto en marcha un ensayo clínico aleatorizado para estudiar los resultados del TH en pacientes seleccionados con metástasis hepática de CCR, a fin de comprobar si éste consigue aumentar la tasa de supervivencia y mejorar la calidad de vida en este grupo de pacientes (NCT01479608).
Complicaciones de la hipertensión portal
1. ASCITIS REFRACTARIA
La ascitis es la complicación más frecuente de la cirrosis, de manera que hasta el 60% de los pacientes con cirrosis compensada desarrollan ascitis en los 10 años siguientes al diagnóstico[81]. La aparición de esta complicación se asocia a un empeoramiento del pronóstico y de la calidad de vida de los pacientes[82], [83].
La aparición de ascitis ocurre únicamente en aquellos pacientes con hipertensión portal[81] y es secundaria a la activación del sistema renina-angiotensina-aldosterona, lo que disminuye la excreción urinaria de sodio. La retención de sodio produce expansión del volumen intracelular y finalmente desarrollo de ascitis y edema. Con la progresión de la enfermedad se altera también la capacidad de excretar agua libre produciéndose finalmente hiponatremia dilucional e insuficiencia renal[83]-[85]. La presencia de ascitis leve y fácilmente controlable con tratamiento médico, implica un pronóstico aceptable a corto y medio plazo[83]. Sin embargo, hasta un 10% de los cirróticos desarrollan ascitis refractaria[81], la cual se asocia a mayor mortalidad (40% y 67% al año y a los dos años respectivamente)[81], [82], [86].
La ascitis refractaria es aquella que no puede controlarse con tratamiento diurético a dosis máximas, o cuando el paciente desarrolla efectos adversos al tratamiento que impiden alcanzar sus dosis máximas (ascitis intratable)[87]. El tratamiento estándar de estos pacientes consiste en paracentesis evacuadoras a demanda con reposición de albúmina. En pacientes seleccionados con función hepática conservada puede colocarse un TIPS (Transjugular Intrahepatic Portosystemic Shunt)[81]-[83], [87]. Otras opciones, utilizadas con menor frecuencia, son los shunts peritoneo-venosos, shunts quirúrgicos o derivaciones peritoneo-vesicales (alfa-pump). Todas estas terapias, aunque mejoran parcialmente la calidad de vida, no suponen un aumento de la supervivencia[81].
La ascitis refractaria condiciona un peor pronóstico y mayor mortalidad en el paciente con cirrosis, por lo que debería de considerarse la realización de TH[86]. En estos pacientes, la puntuación MELD no refleja de modo adecuado su riesgo de muerta a corto plazo. La hiponatremia es un factor de mal pronóstico en pacientes con ascitis refractaria[83], [86], [88], [89] y se asocia a una mayor mortalidad independientemente de la puntuación MELD[88], [90]-[92]. Se ha descrito que por cada ascenso de un miliequivalente del sodio sérico la mortalidad pretrasplante se reduce un 7%[90].
La incorporación del baremo MELD-Na puede ser de utilidad en la priorización de pacientes con ascitis refractaria en lista de espera y MELD bajo[88], [90], [93]-[101]. No obstante, MELD-Na no es un modelo perfecto ya que, a pesar de que es un parámetro objetivo, puede verse modificado por distintos tratamientos (diuréticos, suero, vaptanes, etc.) por lo que su utilidad y aplicación aún debe de ser más estudiada[83].
Por todo lo anterior, los pacientes con ascitis refractaria o complicada deberían de ser candidatos para TH como excepción al MELD, por su mortalidad elevada, especialmente, en aquellos pacientes con puntuaciones de MELD bajas, con similares resultados de supervivencia tras el TH[85], [93], [94]. El sodio sérico es un marcador que se asocia a un peor pronóstico y mortalidad en lista[15], [102], [103]. En Andalucía, los pacientes con ascitis refractaria acceden a la lista de espera con un MELD basal de 15 puntos, y van incrementando 1 punto extra por cada mes de permanencia en lista. A partir de los 18 puntos (3 meses en lista), es posible aplicarles el MELD-Na, de modo que los pacientes con hiponatremia son priorizados para trasplante.
2. ENCEFALOPATÍA HEPÁTICA
La encefalopatía hepática crónica y recurrente se produce habitualmente en pacientes con insuficiencia hepática avanzada, por lo que son pacientes que ya están adecuadamente priorizados en el sistema MELD. Sin embargo, en algunos de estos pacientes no queda adecuadamente reflejada la gravedad en la puntuación MELD, por lo que al ser la encefalopatía predictor independiente de mortalidad a corto plazo[104], [105], precisan de un sistema de priorización independiente. Los datos de mortalidad en esta población podrían estar distorsionados debido a la ausencia de un método de cuantificación de la encefalopatía objetivo, reproducible y verificable, y también por la posibilidad de que en muchos casos el tratamiento recibido haya sido subóptimo. Algunos autores han propuesto la necesidad de intubación orotraqueal y el aumento de la presión intracraneal, como variables objetivas para valorar la gravedad de la encefalopatía hepática, pero esta práctica no está extendida y depende en gran medida de la experiencia de cada centro en particular[106]. Se acepta universalmente que la encefalopatía crónica o recurrente impacta negativamente sobre la calidad de vida y es una indicación de trasplante hepático. La priorización en lista debe ser adaptada a cada ámbito demográfico y geográfico, y consensuada en el marco de equipos multidisciplinares[15]. En Andalucía, estos pacientes pueden ser incluidos en lista con indicación por insuficiencia hepática (siguiente el sistema de priorización MELD), o como indicación especial, si el clínico responsable considera que la puntuación MELD real del paciente no hace justicia a su deterioro clínico, de la calidad de vida y al riesgo de fallecimiento a corto plazo. En este último caso, al igual que en otras indicaciones especiales, el sistema de priorización de la comunidad autónoma andaluza otorga una puntuación MELD inicial de 15 puntos, y un punto extra por cada 3 meses en lista de espera electiva. Adquirida la puntuación MELD de 18 puntos, el paciente pasa a la lista preferente común y recibe un punto MELD por cada dos meses en lista hasta un máximo de 21 puntos.
3. HEMORRAGIA RECURRENTE POR HIPERTENSIÓN PORTAL
La hemorragia digestiva secundaria a hipertensión portal es una complicación frecuente en la cirrosis hepática. Aunque en el 90% de los casos puede ser controlada mediante tratamiento endoscópico, farmacológico o mediante la colocación de TIPS (Transjugular Intrahepatic Portosystemic Shunt), un pequeño porcentaje de los pacientes no responde a dichos tratamientos, en cuyo caso la mortalidad es cercana al 100%[107]. Se define hemorragia varicosa refractaria cuando existe un sangrado agudo y grave que requiere intubación orotraqueal o la colocación de balón de Sensgtaken, a pesar de un tratamiento endoscópico adecuado y corrección de la coagulopatía, en cuyo manejo se requieren más de 6 concentrados de hematíes en 24h o más de dos concentrados al día durante 3 días[108]. En estos casos, siempre que el TIPS esté contraindicado, el TH podría ser una opción de tratamiento. Sin embargo, actualmente no existen datos suficientes para asignarles una prioridad adicional específica[15], [108], [109]. Ocasionalmente puede estar justificada esta prioridad, previa valoración por un comité de expertos[109].
4. SÍNDROME HEPATOPULMONAR
El síndrome hepatopulmonar (SHP) se produce cuando existe una dilatación vascular intrapulmonar anómala que conduce a una alteración en el intercambio de gaseoso en el contexto de una enfermedad hepática y/o hipertensión portal[110], [111]. Es una complicación relativamente frecuente con una prevalencia que oscila entre 15%-20%[103], y que implica un aumento de la morbimortalidad en pacientes cirróticos[110], [111].
El TH representa la mejor opción terapéutica para los pacientes con SHP e hipoxemia severa[112]. Los resultados del TH en estos pacientes en términos de supervivencia son similares a los obtenidos en aquellos pacientes trasplantados sin SHP, y la supervivencia en los pacientes con SHP sometidos a TH es mayor que en aquellos que no se someten a TH[112]. Sin embargo, la historia natural y los factores que condicionan la progresión de la hipoxemia y la mortalidad no están bien caracterizados y no existe una clara asociación entre deterioro de la función hepática y la gravedad del SHP, por lo que la puntación MELD no calcula de forma adecuada la mortalidad en este grupo de pacientes[15]. Fallon et al.[112] sugirieron que en pacientes con shunt intrapulmonar bien documentado y cirrosis existe un aumento de la mortalidad y que la hipoxemia progresiva es un parámetro fácil de determinar, que podría ser útil para predecir la mortalidad en lista de espera y ayudar en la priorización de estos pacientes. Distintos autores han propuesto que aquellos pacientes con PaO2<60 mmHg, shunt intrapulmonar demostrado y sin otra causa de hipoxemia deberían priorizarse en lista. La hipoxemia es un criterio adecuado para determinar la progresión de la enfermedad en lista de espera, ya que es una variable específica, objetiva y fácil de obtener[15]. Sin embargo, en la actualidad, la mayoría de los grupos de trasplante no utilizan la hipoxemia como factor de priorización, de modo que los pacientes son priorizados de forma similar a otras indicaciones especiales.
5. HIPERTENSIÓN PORTOPULMONAR
Aunque la evidencia científica deriva de series pequeñas recogidas a lo largo de extensos periodos de tiempo, parece demostrado que en casos seleccionados el trasplante aporta un claro beneficio de supervivencia, evitando la progresión de la anormalidad pulmonar que resultaría en insuficiencia cardíaca derecha y muerte[113]. Los pacientes con una presión media de arteria pulmonar (mPAP)[114]. Por otro lado, los pacientes con mPAP>45 mmHg sin respuesta al tratamiento médico tienen un pronóstico postrasplante extremadamente malo, por lo que se debe considerar una contraindicación al trasplante. Aunque faltan estudios prospectivos más extensos que confirmen la correlación entre la progresión de la mPAP y la mortalidad en lista de espera, se asume que una mPAP>35 mmHg justifica la priorización y la concesión de puntos adicionales por su permanencia en lista de espera[15]. Los pacientes en los que la hipertensión portopulmonar está bien controlada con vasodilatadores pulmonares no parecen estar excesivamente penalizados por el MELD, por lo que pueden ser manejados en lista únicamente en función de la gravedad de su hepatopatía[15].
Otras excepciones al MELD
1. SÍNDROME DE BUDD-CHIARI
En el Síndrome de Budd-Chiari se produce una obstrucción al flujo de salida hepático, en ausencia de fallo cardiaco derecho o pericarditis constrictiva. Generalmente se produce por trombosis a nivel de las venas suprahepáticas o la vena cava inferior y se caracteriza por el desarrollo de hepatomegalia y ascitis[115]. Su curso evolutivo puede ser crónico y progresivo, con desarrollo de cirrosis, o bien con la aparición de fallo hepático fulminante.
El tratamiento en estos pacientes consiste en tratamiento anticoagulante y diurético, la colocación de un TIPS y el TH[116].En aquellos pacientes que presentan cirrosis descompensada o que desarrollan fallo hepático el TH podría ser la mejor opción de tratamiento[117]-[119]. En este grupo de receptores no existen evidencias de que estén mal priorizados con la puntuación MELD. Por lo tanto, no reciben una priorización adicional[109]. Así, aquellos pacientes con Síndrome de Budd-Chiari y fallo hepático fulminante se incluirán en lista como código cero, y en aquellos en los que se desarrolle cirrosis se priorizarán en función de su puntuación MELD[120].
2. COLANGITIS RECURRENTE POR ALTERACIÓN ESTRUCTURAL DE LA VÍA BILIAR
Los pacientes con alteraciones estructurales de la vía biliar tienen un riesgo elevado de episodios de colangitis y sepsis de repetición, con el consecuente deterioro de la calidad de vida. Aunque el TH es la mejor opción cuando no existe una estenosis biliar dominante sugestiva de tratamiento endoscópico, la mayoría de estos pacientes tienen una función hepática conservada, por lo que la puntuación MELD puede no ser adecuada a la hora de priorizarlos. No existe evidencia suficiente para establecer cuál es el criterio objetivo más apropiado para su priorización y, de forma general, se considera que los pacientes con patología estructural de la vía biliar no corregible con episodios de colangitis de repetición y criterios de gravedad, deben recibir prioridad adicional. Así, desde algunos grupos norteamericanos[121] se ha recomendado corregir el MELD del paciente con una equivalencia del 8% de mortalidad, y con un incremento del 8% cada tres meses. Sin embargo, para que este sistema de priorización se aplique, los pacientes deben de cumplir una serie de criterios: (1) Al menos dos episodios de colangitis, demostrándose bacteriemia en al menos 2 hemocultivos o pacientes con complicaciones sépticas de la colangitis (abscesos hepáticos, meningitis bacteriana, endocarditis, osteomielitis); (2) bacteriemia no sea iatrogénica; (3) que los pacientes no tenga prótesis biliares; (4) que el tratamiento antibiótico haya fracasado[121]. El grupo de trasplante español, recomienda adjudicar prioridad adicional a los pacientes con lesión estructural de vía biliar no corregible que hayan presentado colangitis de repetición con criterios de gravedad (shock séptico y/o complicaciones sépticas extrahepáticas) previa valoración por un comité de expertos[109].
3. FIBROSIS QUÍSTICA
La fibrosis quística (FQ) es una enfermedad sistémica, producida por mutaciones en el gen CTFN. Es la enfermedad genética más frecuente en la raza caucásica con una prevalencia de 1/2.000 nacimientos. La principal causa de morbimortalidad está relacionada con el desarrollo de enfermedad pulmonar progresiva, y ésta es precisamente, la principal indicación de trasplante pulmonar. La afectación hepática ocurre en un 3%-7% de los pacientes, proporción que aumenta con la edad, de manera que hasta un 10% de los pacientes con más de 16 años presentan enfermedad hepática[122]. El TH está indicado en pacientes con FQ y enfermedad hepática avanzada, obteniéndose buenos resultados en cuanto a supervivencia y mejoría de la calidad de vida[123].
La realización de espirometría y el cálculo del volumen espiratorio forzado (FEV1) podrían ser herramientas útiles para identificar aquellos pacientes susceptibles de priorización adicional en la lista de espera. En los pacientes con FQ con función pulmonar conservada (FEV1>40%) y enfermedad hepática avanzada, el riesgo de mortalidad está bien estimado por el sistema MELD, sin embargo, aquellos pacientes con deterioro en la función pulmonar (FEV1<40%) y aquellos que necesiten un trasplante combinado hígado-pulmón deberían ser priorizados en lista de espera[124]. En los pacientes con disfunción hepática y pulmonar avanzadas los resultados del TH exclusivo no son buenos, debiendo considerarse el trasplante combinado hígado-pulmón[124]-[126].
4. POLINEUROPATÍA AMIOLIDÓTICA FAMILIAR
La polineuropatía amiloidótica familiar (PAF) es un trastorno metabólico con herencia autosómica dominante, en la que se produce una mutación en transtirretina (TTR), una proteína transportadora de síntesis hepática. Esta mutación provoca un depósito de amiloide en distintos órganos y tejidos que da lugar a afectación multiorgánica que llevan a la muerte aproximadamente a los 10 años del inicio de los síntomas. Las manifestaciones clínicas más características de esta patología son: neuropatía autonómica periférica, cardiomiopatía, nefropatía, malnutrición y opacidad vítrea.
El TH es el único tratamiento eficaz en esta patología ya que permite eliminar la proteína mutada, y por lo tanto frenar el depósito de amiloide y el deterioro multiorgánico[15]. En estos pacientes la mortalidad no depende de la función hepática, por lo que la puntuación MELD no es capaz de predecir la necesidad de TH. No está bien estudiado cuáles son los factores que determinan el riesgo de muerte de estos pacientes, aunque se han propuesto algunos como el grado de disfunción cardíaca, los parámetros nutricionales y la presencia de polineuropatía, ya que son paciente-específicas, objetivas y fáciles de determinar. Se han realizado distintas propuestas para optimizar la priorización en lista de espera de estos pacientes. El consenso francés[104] acepta la priorización automática, pero ajustada a la evolución de la enfermedad: si el paciente presenta alteración motora, síntomas digestivos o alteración nutricional se adjudica una puntuación que facilita el acceso al trasplante en tres meses, en los casos con polineuropatía sensitivomotora y/o disautonomía se otorga una puntuación que permite el acceso al trasplante en 6 meses. Por último, si el paciente sólo presenta polineuropatía sensorial, la puntuación será la correspondiente a la probabilidad de acceso al trasplante en 12 meses. El modelo norteamericano acepta la priorización con la puntuación MELD correspondiente a una mortalidad del 15% a los 3 meses (incrementándose un 10% cada 3 meses), sin embargo en este grupo es necesaria la confirmación histológica, mediante biopsia hepática de la presencia de la mutación. Además, los pacientes con disfunción cardiaca severa (NYHA IV o FE<40%) deben ser considerados candidatos para trasplante combinado hígado-corazón. En España, el grupo andaluz acepta la priorización automática, mientras que el modelo catalán otorga al paciente con PAF el MELD de su potencial receptor de trasplante dominó[109]. En estos pacientes está claramente establecido que el trasplante solo es beneficioso cuando la enfermedad está poco evolucionada. Entre los factores de mal pronóstico en los pacientes trasplantados por PAF está el inicio tardío de la enfermedad, la presencia de una mutación diferente a la Valina30Metionina, la disautonomía (incontinencia urinaria o hipotensión ortostática), la afectación neurológica avanzada o el índice de masa corporal modificado (índice de masa corporal x albúmina sérica)[127].
En estos casos existe la posibilidad de realizar el llamado trasplante dominó, mediante el cual, el hígado del paciente con PAF es trasplantado a otro paciente en lista activa de trasplante. Con esta medida se consiguen adecuadas tasas de supervivencia (supervivencia del 91,8% y 88,4% al año y a los 5 años respectivamente), así como "ahorrar" un hígado del pool de donantes. Aunque no es frecuente, se han descritos algunos casos en los que se ha producido el desarrollo de la enfermedad en el receptor a los 7-8 años del trasplante[127]. Se recomienda que estos pacientes deben ser considerados para trasplante dominó siempre que sea posible excepto en aquellos casos en los que el depósito de amiloide se produzca en el hígado[127].
5. POLIQUISTOSIS HEPÁTICA
La poliquistosis hepática aislada es una indicación poco frecuente de trasplante hepático y en rara ocasión supone un aumento de la mortalidad que justifique su priorización en lista. En algunos pacientes supone un importante deterioro en su calidad de vida debido a la aparición de desnutrición, infecciones de repetición e incluso el desarrollo de ascitis[15]. En estos casos se debería de considerar el trasplante hepático como opción terapéutica, aunque no existe suficiente evidencia para recomendar su priorización en lista, por lo que cada caso deberá ser evaluado de forma individual por un comité de expertos[15], [109]. En aquellos pacientes con afectación hepatorrenal, que desarrollen insuficiencia renal, ésta será la que determine la necesidad de trasplante renal o incluso trasplante combinado hígado-riñón[109].
6. HIPEROXALURIA PRIMARIA
La hiperoxaluria primaria (HP) es una enfermedad de base genética en la que existe un déficit enzimático, que provoca depósitos progresivos de oxalato en distintos órganos. En la HP tipo 1 existe un déficit de la enzima alanina glioxilato aminotransferasa (AGT), que provoca depósito de oxalato a nivel renal y a medida que la enfermedad progresa, también en otros órganos[122]. La presencia de disfunción renal con necesidad de diálisis acelera la progresión de los depósitos de oxalato a otros niveles, ya que las actuales modalidades de diálisis no consiguen eliminarlos. Existen varios estudios que demuestran que el TH es eficaz en esta enfermedad, sin embargo no existe disfunción hepática y, por lo tanto la puntuación MELD no refleja la verdadera necesidad de trasplante en estos pacientes. El TH precoz en la enfermedad poco evolucionada evita el deterioro multiorgánico y sobre todo el desarrollo de insuficiencia renal, que se asocia a mayor mortalidad. En aquellos pacientes en los que ya se ha desarrollado disfunción renal, el trasplante renal exclusivo provoca daño en el injerto por el depósito de oxalato, por lo que en estos pacientes debe realizarse un trasplante combinado hígado-riñón. Por ello, algunos modelos como el americano exigen la confirmación por biopsia del déficit enzimático y determinan la urgencia según la función renal: en caso de requerir TH o trasplante hepatorrenal, pero no diálisis, se asigna el MELD correspondiente al 10% de mortalidad en lista, con incremento cada 3 meses. En los pacientes en diálisis se asigna el MELD que corresponde a un 15% de mortalidad en lista[103].
7. PRURITO REFRACTARIO
El prurito refractario es una manifestación extrahepática frecuente en algunas enfermedades colestásicas. Generalmente se consigue un adecuado control del mismo con los tratamientos médicos. Sin embargo, en algunos pacientes el prurito es refractario a todas las medidas terapéuticas instauradas, lo cual provoca una marcada disminución de la calidad de vida de los pacientes aunque no conlleva un aumento en la mortalidad. Así pues, el prurito refractario incoercible como situación aislada, no se considera criterio de excepción para el TH, sino que debe ser valorado en el contexto de las patologías de base (cirrosis biliar primaria, otras patologías colestásicas) y una vez agotadas todas las demás opciones terapéuticas. Si bien en algunos pacientes la adecuada función hepática no refleja el deterioro en la calidad de vida ocasionado por este síntoma, no se ha llegado a consensuar una recomendación de puntuación suplementaria[15], [109], [120].
8. ENFERMEDADES METABÓLICAS HEPÁTICAS
Son enfermedades poco frecuentes, por lo que realizar recomendaciones basadas en la evidencia es casi imposible. En aquellos trastornos que conllevan el desarrollo de disfunción hepática y cirrosis, como la hemocromatosis, la enfermedad de Wilson o el déficit de alfa-1-antitripsina, la puntuación MELD/PELD es útil para valorar la necesidad de TH. Para otras enfermedades metabólicas en las que no existe alteración estructural hepática, no hay suficiente evidencia que justifique priorizaciones automáticas, por lo que cada caso debe ser valorado por comités de expertos[15], [128].
9. TELANGIECTASIA HEMORRÁGICA FAMILIAR
También llamado síndrome de Rendu-Osler-Weber, es una enfermedad sistémica caracterizada por la presencia de malformaciones vasculares. La afectación hepática es frecuente con presencia de malformaciones arteriovenosas. La afectación hepática puede manifestarse como insuficiencia cardiaca, hipertensión portal o alteraciones biliares (estenosis) generalmente secundarias a fenómenos isquémicos. En casos de sepsis grave, insuficiencia cardiaca refractaria a tratamiento o hemorragia intrahepática, el TH podría estar indicado. No hay datos suficientes para hacer una priorización automática en estos pacientes[15]. En el sistema norteamericano se ha propuesto asignar un MELD de 40 en aquellos casos con necrosis biliar aguda y un MELD de 22 para los pacientes con fallo cardíaco refractario a tratamiento médico[128].
Conclusión
Las indicaciones especiales de TH o excepciones al MELD son situaciones frecuentes en nuestro medio. La priorización en lista debe ser específica para cada una de estas situaciones, y debe asegurar un acceso equitativo al trasplante con respecto a los pacientes con indicaciones convencionales. En nuestro medio, los pacientes con indicaciones especiales reciben empíricamente puntos MELD extra por tiempo de permanencia en lista o por progresión de la enfermedad basal. Es fundamental realizar auditorías periódicas del sistema de priorización para asegurar que respeta los principios éticos más elevados de equidad, urgencia y utilidad. Éste es, probablemente, uno de los mayores retos a los que se enfrentan los profesionales involucrados en el trasplante de órganos.