Caso clínico
Mujer de 67 años con antecedentes de HTA, esclerodermia limitada con afectación esofágica, Raynaud y asma acude a Urgencias por rectorragia, dolor en hemiabdomen inferior, vómitos y febrícula. Analíticamente destaca anemia normocítica normocrómica y leucocitosis con neutrofilia.
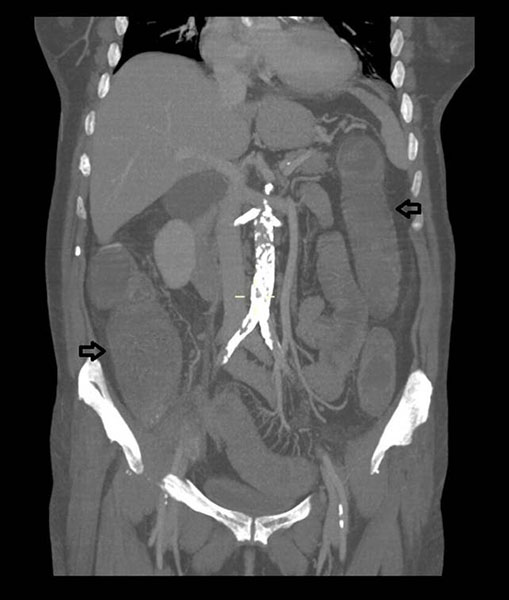
Por la postración de la paciente se realiza una TAC abdomino-pélvica que objetiva distensión colónica con pérdida de las haustras sobre todo a nivel de colon ascendente y descendente (Figura 1) y afectación parietal segmentaria en sigma con signo del doble halo, sugestivo de proceso inflamatorio/isquémico a este nivel sin que se observen defectos de repleción en arteria mesentérica superior.
Figura 1
TAC abdomino-pélvica con contraste iv, corte coronal. Se objetiva distensión del colon y pérdida de las haustras a nivel de colon ascendente y descendente (flechas).
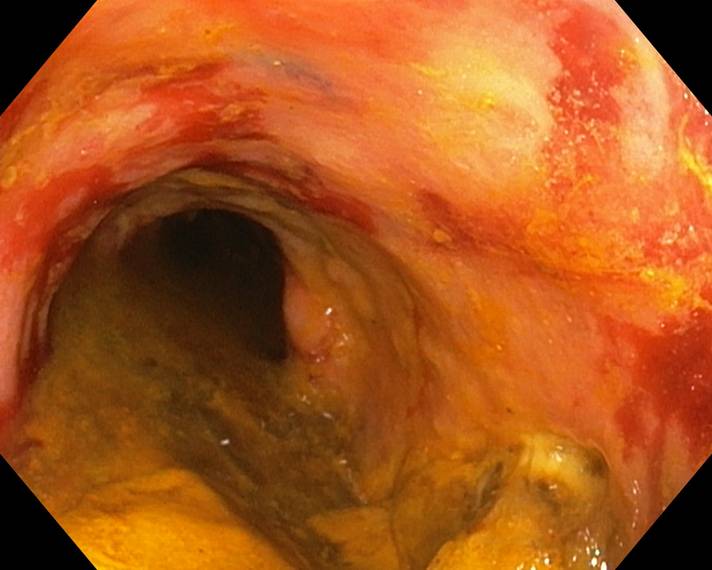
Al ingreso se solicita estudio analítico completo que es normal y serologías virales (VIH, VHC, VHB, VEB, parvovirus B19) negativas con CMV IgG+ e IgM-. Hemocultivo, urocultivo, coprocultivo, estudio de parásitos en heces y determinación de toxinas de Clostridium difficile resultando todo negativo. En la colonoscopia se explora hasta colon ascendente y se objetivan desde recto úlceras profundas fibrinadas que tapizan casi por completo la mucosa (Figura 2), con biopsias que muestran inflamación crónica inespecífica y tejido de granulación con material fibrino-leucocitario de fondo de úlcera.
Figura 2
Colonoscopia en la que a nivel del colon transverso se aprecia eritema, pérdida del patrón vascular normal, úlceras superficiales y friabilidad. Además de restos fecales por una mala preparación catártica.
Se establece el diagnóstico de sospecha de enfermedad inflamatoria y se inicia tratamiento corticoideo y antibiótco intravenoso y nutrición enteral. Se produce un empeoramiento clínico de la paciente acompañado de una pancitopenia resistente a tratamiento con inmunoglobulinas y factor estimulante de colonias, demostrándose hipocelularidad global tras la punción medular. Se plantea realizar biopsia de cresta ilíaca para el diagnóstico de aplasia medular pero la decisión de la familia de no realizar nuevas pruebas invasivas y el importante deterioro de la paciente lo desaconsejan.
Durante el ingreso se realiza una segunda colonoscopia completa hasta ciego con hallazgos superponibles a la previa y afectación hasta ciego, se toman biopsias escalonadas y muestras para cultivo. En ellas se objetivan 628 copias de ADN de CMV con negatividad para micobacterias. Se inicia tratamiento con foscarnet (la posibilidad de inducir citopenias del ganciclovir lo contraindican) sin respuesta y produciéndose el éxitus de la paciente.
La infección por CMV, virus de la familia de los Herpesviridae, tiene una altísima prevalencia mundial[1]. La infección primaria se produce por contacto directo con orina, saliva, secreciones vaginales, semen y leche materna de una persona infectada por CMV.
Tras la infección primaria el virus pasa a un estado de latencia pudiendo aparecer recurrencias por reinfección con una cepa nueva o por reactivación de la replicación del CMV latente. Los cuadros clínicos más graves se dan en la infección congénita y en pacientes inmunodeprimidos (trasplantados, VIH) cuya gravedad está en relación con el grado de inmunosupresión. En sujetos inmunocompetentes suele tener un curso subagudo e incluso asintomático[1],[2].
Para su diagnóstico se usan los test serológicos que miden la presencia de anticuerpos frente a CMV[2],[3]. Los métodos de amplificación molecular (PCR) permiten cuantificar la positividad en copias de genoma por ml de muestra y se pueden realizar en muestras de orina, sangre completa y plasma[4]. En la enfermedad invasora el gold estándar para el diagnóstico es la identificación de las inclusiones por CMV o tinción inmunohistoquímica positiva para CMV en las muestras. Un cultivo positivo de una muestra de biopsia también se considera una prueba diagnóstica consistente[2],[4].
Existen pocos casos descritos de afectación orgánica diseminada por CMV en sujetos inmunocompetentes, habiéndose descrito afectación de diversos órganos, entre ellos son escasos los referentes a enterocolitis por CMV en la literatura mundial[5],[6]. Al revisarla se aprecia que el promedio de edad de estos pacientes es de 68 años, los síntomas acompañantes fueron diarrea (76%), dolor abdominal (52%) y hematoquecia o melenas (27%) y la evolución suele ser favorable incluso sin tratamiento[7].
La afectación de médula ósea puede ser consecuencia de la invasión directa del virus sobre las tres series inhibiendo su crecimiento o de la disregulación a la baja del factor estimulante de colonias[8]. Ambos podrían corresponderse con nuestro caso, en el que no se apreció hematopoyesis activa, aunque no se llegó a determinar el DNA viral en médula ósea.
El tratamiento de elección es el ganciclovir y foscarnet, con trabajos que sugieren que en sujetos inmunocompetentes seleccionados no sería necesario iniciar tratamiento antiviral[9],[10].
Por tanto, la detección del CMV se debería incluir en el estudio de colitis y pancitopenia resistentes a tratamiento convencional en individuos inmunocompetentes, especialmente en poblaciones de edad avanzada, para la instauración precoz de tratamiento antiviral y evitar el uso de corticoides que puedan inducir cierto grado de inmunosupresión que favorezca la persistencia de la infección subyacente. Aunque se trate de una enfermedad rara, es potencialmente grave y con una morbilidad significativa como ocurrió en el caso que aquí presentamos.