Introducción
La infección por el Virus de la Hepatitis B (VHB) afecta a aproximadamente 2000 millones de personas en todo el mundo según la OMS, de las cuales 350-400 millones padecen infección crónica[1]. En la historia natural de la infección por VHB, es bien conocida la persistencia del virus durante décadas en el huésped una vez superada la fase aguda de la infección, quedando en la mayoría de casos controlada su actividad por la acción del sistema inmune. En determinadas circunstancias, por lo general ligadas a descenso en la inmunidad efectiva del sujeto, puede darse lugar a la reactivación del virus, con potenciales consecuencias clínicas de magnitud variable.
Definición y Fisiopatología
La reactivación del VHB se define como la reaparición de DNA sérico, o brusca elevación de éste (Δ≥1log), en un paciente con infección VHB previamente resuelta o bien inactiva. A veces (aunque no siempre), esta variación del DNA se acompaña de actividad inflamatoria o hepatitis aguda propiamente dicha (hipertransaminasemia >3xVN)[2] . Hablaremos, pues, de reactivación y de hepatitis por reactivación como dos conceptos diferentes.
Así pues, nos encontraremos con dos escenarios de partida en los que se puede producir dicha reactivación[3]:
· Portador inactivo VHB. Dentro de la historia natural de la infección, es la fase en la que, presentando el paciente niveles bajos de DNA (<2000 UI/ml) y transaminasas persistentemente normales, el virus muestra mínima actividad necroinflamatoria, con buen pronóstico a largo plazo[4].
· Hepatitis B oculta. Se define como la persistencia de DNA viral en tejido hepático (puede existir también DNA sérico) en ausencia de HBsAg. Se puede dar en sujetos con serología de hepatitis B pasada (HBcAc+ con o sin HBsAc+) o incluso con serología por completo negativa, y se explica por la persistencia duradera de DNA viral en forma "ccc" (circular covalente cerrado) en el núcleo hepatocitario. Éste actúa como reservorio que, en circunstancias como el déficit inmunitario, puede recuperar su capacidad de transcripción para que la infección resurja[5]. Se desconoce con exactitud la prevalencia de la infección oculta VHB pero ésta es variable según grupos de riesgo, y en la población general puede alcanzar el 8-18% en áreas de alta endemicidad[6].
En las dos situaciones descritas, la inactividad del VHB se mantiene gracias a un equilibrio entre la replicación del virus y el control inmunológico del huésped, pero dicho equilibrio puede romperse, y tener lugar la reactivación ante el aumento de la primera o el descenso del segundo.
Aumento de la replicación viral:
- Aumento espontáneo. Es el mecanismo habitual de paso de portador inactivo a hepatitis crónica activa que se produce en pacientes no sometidos a inmunosupresión (IS), con un riesgo estimado del 15% en 3 años[7].
- Resistencia a tratamiento antiviral. Es una situación anecdótica con el actual uso de Análogos de Nucleós(t)idos (ANs) de tercera generación.
- Retirada brusca del tratamiento antiviral. Generalmente, por falta de adherencia.
- Reactivación en Coinfección VHB/VHC durante tratamiento antiviral directo (AAD). Con las terapias para el VHC que contenían Interferón Pegilado alfa, se describían hasta un 38% de ascensos de DNA durante el tratamiento, no acompañados no obstante de hepatitis aguda por lo general, y sí de aclaramiento del AgS en un 30% de casos[8]. Se han publicado los primeros casos de reactivación del VHB durante el tratamiento con AAD libre de Interferón, con hepatitis clínica asociada, que característicamente puede producirse en las primeras semanas de terapia, en probable relación con la rápida indetectabilidad del RNA del VHC que obtienen los nuevos fármacos[9]-[11]. En este sentido, el Comité de Farmacovigilancia de la EMA está realizando en la actualidad una revisión de casos para establecer unas recomendaciones al respecto.
Descenso de la inmunidad del huésped:
La respuesta inmune inicial contra el VHB se fundamenta en la respuesta innata, mediada sobre todo por los Natural Killer (NK) y las Células T NK, así como por la producción de Factor de Necrosis Tumoral Alfa (TNFa). El TNFa ha demostrado promover el aclaramiento viral y reducir su replicación, lo que explicaría el efecto reactivador de los AntiTNF. Aunque esta respuesta innata puede controlar la replicación viral, no actúa sobre los hepatocitos infectados.
La eliminación del virus requiere de una firme respuesta adquirida celular, ejecutada por los linfocitos T CD4 y, especialmente, los CD8, que además poseen la capacidad de mantener una actividad citotóxica con memoria duradera en pacientes curados. Los CD4, sin mediar la lisis de las células infectadas como hacen los CD8, tienen también una labor fundamental como células presentadoras de antígeno.
La respuesta adquirida humoral, por su parte, actúa desarrollando anticuerpos que proporcionan protección a varios niveles[2], [3], [12], [13].
Nos podremos encontrar con varias situaciones que conducen al fallo de parte de este sistema:
- IS espontánea o asociada a enfermedades.
- IS secundaria a infección por VIH.
- IS yatrógena, en el post-trasplante de órganos, durante quimioterapia o en el tratamiento de enfermedades inflamatorias/autoinmunes. Los fármacos IS pueden interferir en uno o varios de los pilares defensivos referidos, con lo que el virus puede eludir los mecanismos defensivos y proliferar.
Historia natural y Patrones de reactivación
Cuando tiene lugar una hepatitis por reactivación, ésta cursa clínica y analíticamente en tres fases[14]:
- Replicación del virus, en cualquier momento durante el periodo de IS o incluso una vez finalizada la terapia IS.
- Elevación de transaminasas, como señal de respuesta del organismo sobre los hepatocitos infectados. La mediana de tiempo que transcurre entre la elevación del DNA y el pico de GPT es de 2-3 semanas[15].
- Desenlace del episodio, ya sea en forma de resolución de hepatitis aguda, de cronicidad de la misma o, en algunos casos, de hepatitis fulminante.
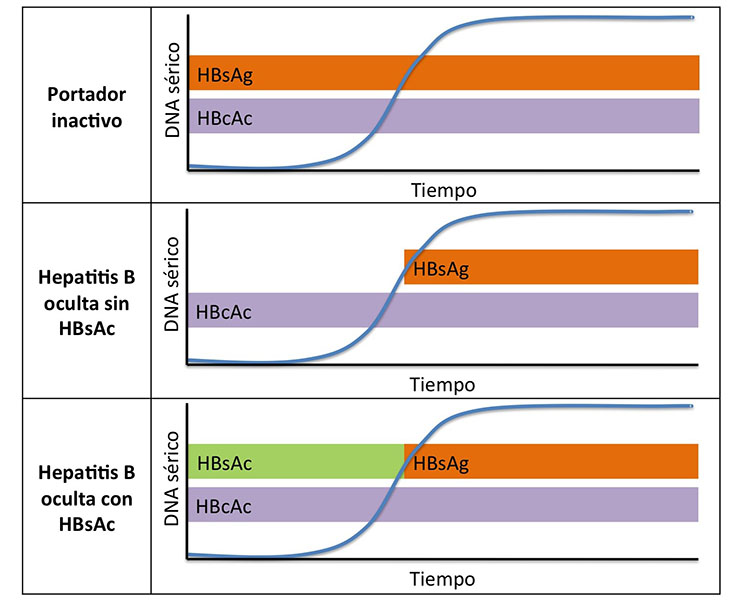
El curso serológico durante la reactivación será diferente según el escenario de partida (Figura 1)[2]:
· En portadores asintomáticos, la serología permanecerá igual (como única posible variación, aunque anecdótica, la serorreversión de AgE- a AgE+ es posible).
· En pacientes HBsAg-/HBcAc+, la elevación de DNA se sigue de aparición de HBsAg, y ésta de la hepatitis en caso de ésta producirse.
· En pacientes con HBsAc+/HBcAc+, tras la reaparición del DNA, se producen la desaparición del HBsAc y la serorreversión HBsAg. Este patrón se ha descrito con más frecuencia en pacientes que han recibido Trasplante de Células Hematopoyéticas, y suele presentarse de forma más tardía (incluso 1-3 años tras el trasplante). Presenta menor tasa de hepatitis pero, de presentarse, ésta suele ser más agresiva.
La aparición tardía de hepatitis, una vez finalizada la terapia inmunosupresora, es un curso atípico pero a tener en cuenta en determinados pacientes. Más común en trasplante medular, como se ha comentado, y en regímenes de IS más profunda, parece explicarse por el particular fenómeno de reconstitución inmune que estos pacientes, especialmente, experimentan. Se trata de una respuesta inmune celular exagerada que tiene lugar una vez finalizado el periodo variable (de hasta >6meses) en el que el sistema inmune, aún en vías de recuperación, no ha podido frenar la replicación viral. Las células T, activadas, provocan destrucción hepatocitaria y, así, hepatitis aguda de gravedad variable, en algunos casos fulminante[16].
Reactivación en pacientes HBsAg+
Pacientes HBsAg+ sometidos a Quimioterapia
El mayor número de casos comunicados e incluidos en ensayos pertenece a este grupo. En general, la incidencia de reactivación oscila en un 20-50% de los portadores asintomáticos sometidos a IS, y la mortalidad asociada asciende a un 26%[17]. Se han identificado varios factores de riesgo:
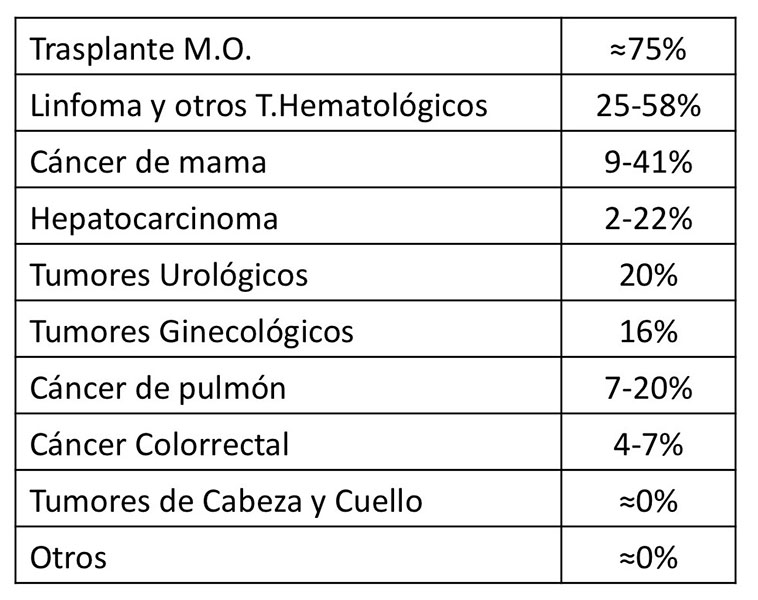
- Tumor por el que se recibe la terapia IS. El riesgo asociado según la patología que ocasiona el uso de tratamiento IS se resume en la figura 2[18]-[21]. Aunque los porcentajes son variables según las series, la superioridad diferencial es llamativa en el caso de los tumores hematológicos, que presentan hasta 5 veces más riesgo comparados con los tumores sólidos.
- Grado y Tipo de Inmunosupresión. La probabilidad de desarrollar reactivación ha demostrado ser proporcional a la intensidad de la quimioterapia en las neoplasias[22], pero no sólo la magnitud de la IS tiene un impacto sobre ésta, sino también el fármaco recibido. Mención especial merece Rituximab (RTX), anticuerpo monoclonal aprobado en 1997 para el tratamiento del Linfoma no Hodgkin, y actualmente indicado en varios procesos oncológicos y autoinmunes, incluso como terapia de primera línea al ser bien tolerado y presentar escasa toxicidad. Induce la muerte de los linfocitos B por un mecanismo directo de lisis, al unirse a su receptor CD20 de superficie. Dicha acción es potente y duradera (hasta 1 año) lo que explica que se asocie hasta a un 80% de reactivación en pacientes HBsAg+ y que hasta un 29% de los casos se produzcan pasados 6 meses tras su suspensión[23].
- Asociación a Corticoides. El DNA-VHB contiene un elemento regulador de la transcripción que es sensible a la estimulación glucocorticoidea. De este modo, los corticoides aumentan el VHB deprimiendo la actividad de Cél-T Citotóxicas, pero también estimulando directamente la replicación del virus[24]. Esto explica que, en estudios comparativos, los regímenes que asocian corticoides muestren una mayor tasa de reactivación, llegando a duplicarse el riesgo acumulado a los 9 meses[25].
- Presencia de DNA detectable basal. Incluso en rangos muy bajos, la detectabilidad del DNA previa al tratamiento incrementa el riesgo de reactivación[20].
- Estatus AgE. Los pacientes HBeAg+ presentan mayor tasa de reactivación.
- Otros. Se han relacionado el sexo masculino o la edad joven con un mayor riesgo de reactivación, aunque dicha relación no parece ser tan firme en otras publicaciones[26], [20].
Pacientes HBsAg+ inmunosuprimidos por enfermedades no oncológicas
Las terapias IS administradas en enfermedades reumatológicas, inflamatorias y autoinmunes provocan, en general, un descenso menos marcado en la inmunidad del paciente, por lo que el riesgo de reactivación es menor. Su uso, no obstante, está más extendido cuantitativamente y es de manejo cotidiano en un mayor número de especialidades, lo que puede conducir a un menor cumplimiento de cribado de VHB y a un menor control de los posibles casos.
En el estudio REPENTINA, se recogieron datos de 104 pacientes, de 19 hospitales españoles, con Enfermedad Inflamatoria Intestinal y serología VHB +, sometidos a inmunosupresión farmacológica (84% corticoides, 69% azatioprina, 32% antiTNF, 8% ciclosporina, 5.6% metotrexate, 1.9% tacrolimus). De los 25 HBsAg+ de la muestra, 9 presentaron reactivación (36%), siendo el uso de 2 o más IS en combinación el factor pronóstico más estrechamente asociado (p=0.08)[27].
Con respecto a la evidencia de riesgo según cada grupo farmacológico:
· Rituximab: Su riesgo se ha expuesto en el epígrafe anterior.
· AntiTNF: La incidencia de reactivación puede alcanzar casi el 40%, asociada a un 5% de mortalidad[28]. Entre los fármacos más usados, es Infliximab el que parece estar involucrado en más casos, frente a Etanercept o Adalimumab[29].
· Corticosteroides: La estimación real del riesgo de reactivación es difícil de conocer por dos limitaciones en las publicaciones que son la escasa homogeneidad en las dosis (en series de casos) y la asociación de otros IS en los grupos (en estudios más amplios)[30]. Entre los escasos trabajos sobre pacientes en monoterapia, destaca el de Kim T y cols, que demuestra una tasa de reactivación en pacientes EPOC bajo corticoides orales del 11%, frente a un 3.2% en pacientes con tratamiento inhalado, siendo las dosis superiores a 20mg de Prednisona (o equivalentes) o los tratamientos mayores de 3 meses las variables asociadas a mayor riesgo[31]. Este dato se asemeja a la definición de dosis inmunosupresora de esteroides según el Advisory Committee on Immunization Practices (equivalente a 20mg de Prednisona durante más de 2 semanas)[32], que es la actualmente considerada de riesgo alto de reactivación VHB para este grupo farmacológico.
· Otros inmunosupresores: La mayoría de estudios han sido realizados en pacientes con enfermedades reumatológicas donde, bajo las siglas FARME (Fármacos Antirreumáticos Modificadores de la Enfermedad), se engloba un conjunto de terapias como Azatioprina, Metotrexate, Ciclosporina y otros. Éstas, en combinación o no con Corticoides, presentan una incidencia muy variable de reactivación (6-50%) dada la heterogeneidad de las combinaciones incluidas en el grupo y el escaso número muestral en muchas de las series[33]. Así pues, el único modo de individualizar el riesgo de cada fármaco es a través de los casos comunicados en monoterapia. Atendiendo a esto, es el Metotrexate el fármaco que más se ha visto implicado en reactivación de VHB, si bien en series de casos que por su escasez no permiten cuantificar el riesgo[34]-[37], por lo que las precauciones en su uso vienen determinadas más por su potencial hepatotoxicidad que por la reactivación en sí. No se han descrito casos de reactivación con Ciclosporina ni Azatioprina en monoterapia.
Reactivación en pacientes HBsAg-/HBcAc+
Con una incidencia menor, la reactivación en pacientes con Hepatitis B Oculta se ha descrito ampliamente en la literatura en el contexto de Trasplante de Células Hematopoyéticas y con el uso de RTX[17], [38].
En el primer caso, la IS es especialmente intensa y duradera, lo que favorece que la reactivación pueda producirse de forma tardía, con una mediana de 18 meses tras el trasplante, y un riesgo acumulado que puede alcanzar el 70% a los 5 años. No son infrecuentes, como se comentó previamente, los casos de reactivación en pacientes con HBcAc+ y HBsAc+[39]-[42].
El tratamiento con RTX, por su parte, alcanza una tasa de reactivación del 25%[43], y aunque de forma menos llamativa, también puede precipitar casos tardíos (tasa acumulada, 41,5% a los 2 años). Seto WK y cols observaron que, de 19 casos de reactivación analizados, 10 se produjeron tras finalizar la terapia, 3 de ellos más allá del año de su cese. En el mismo estudio, se comprobó que el mayor factor de riesgo asociado a la reactivación era la ausencia de HBsAc[44].
El anticuerpo monoclonal AntiCD[52] Alentuzumab, aunque con menor evidencia en su haber por su reciente comercialización, se ha relacionado, en series de casos publicadas, con reactivación en el perfil de hepatitis B oculta hasta en un 29% de pacientes[45].
La asociación de otras terapias con reactivación en pacientes HBsAg- es anecdótica. Hay puntuales casos publicados con Tacrólimus y Metotrexate[46], [47], y algunos estudios con Anti-TNF con resultados dispares, aunque un reciente meta-análisis cifra la incidencia en <2%[48].
Por último, aunque no se dispone de recomendaciones de manejo específicas al respecto, existen recientes estudios que describen un riesgo incrementado de reactivación en pacientes HBsAg-/HBcAc+ sometidos a Quimioembolización Transarterial en contexto de Hepatocarcinoma (9,3-11%)[49], [50] cifras que podrían hacer plantear la conveniencia de profilaxis en futuras guías.
Manejo de la reactivación VHB
Las estrategias de tratamiento en el paciente con hepatitis aguda B por reactivación ya instaurada se resumen en el inicio urgente de terapia antiviral y la suspensión de la terapia IS[3]. Se ha de individualizar, para esto último, el balance riesgos-beneficios del cese en cada paciente y tener en cuenta, además, que una segunda reactivación tras la reintroducción del fármaco no es improbable[2].
Sin embargo, las evidencias a favor del tratamiento preventivo frente al de la reactivación establecida han hecho que la profilaxis sea el abordaje estratégico recomendado.
Beneficios del tratamiento profiláctico
El empleo de ANs de forma profiláctica en pacientes de mayor riesgo se ha comparado con el tratamiento de la reactivación establecida, en 3 estudios prospectivos[51]-[53], y ha mostrado clara superioridad en la prevención tanto de la reactivación como de hepatitis aguda asociada a ésta, logrando reducir ésta última a un 0-7% respecto al 46-48% producido sin profilaxis. En un meta-análisis sobre 396 pacientes recogidos en 9 trabajos se obtuvieron similares conclusiones[54], que avalan la clara conveniencia de la estrategia profiláctica, sin haberse podido demostrar, no obstante, un impacto significativo sobre la mortalidad salvo en alguna serie retrospectiva[55].
Población diana para el tratamiento profiláctico
De lo expuesto previamente, se concluye que sólo los individuos nunca expuestos al VHB, vacunados o que han desarrollado HBsAc tras infección son los únicos que, con un riesgo casi inexistente, no requerirán profilaxis en ningún caso si son expuestos a IS. El resto, incluyendo pacientes HBsAg- con HBsAc+, son posibles candidatos a tratamiento en función del tipo de IS recibida.
En la figura 3, está expuesto el riesgo de producir reactivación de cada fármaco en cada perfil serológico[56]. Tendrán indicación de tratamiento profiláctico todas aquellas situaciones de riesgo farmacológico moderado al menos, sombreadas en la tabla.
Tratamiento farmacológico a emplear
La mayoría de estudios que han demostrado la eficacia del tratamiento se han realizado con Lamivudina (primer AN desarrollado), lo que supone una limitación por su menor potencia antiviral y, en especial, por su baja barrera genética en comparación con los posteriores ANs.
Por las características propias de los ANs de 3ª generación (Entecavir y Tenofovir), se les ha presupuesto una más eficaz labor profiláctica en la reactivación del VHB, y en el único estudio prospectivo aleatorizado, que enfrenta a Lamivudina con Entecavir en pacientes HBsAg+, Entecavir se muestra superior en la prevención de hepatitis por reactivación y en la no-suspensión de terapias[57]. Los resultados preliminares del estudio PREBLIN, que evalúa la eficacia de Tenofovir en la profilaxis, también confirman su utilidad con dicha indicación[58].
La duración de la terapia profiláctica no está estrictamente definida pero:
- En todos los ensayos clínicos, el antiviral antecede una semana a la terapia IS o se inicia al mismo tiempo.
- Se recomienda mantener el AN hasta 6-12 meses tras la suspensión de la IS, al comprobarse que, manteniéndolo sólo 3 meses, la reactivación podía tener lugar de forma tardía en una cuarta parte de pacientes[59]. La decisión entre 6 o 12 meses podría basarse, razonablemente, en el riesgo de reactivación tardía, que como se ha comentado está incrementado especialmente en TMO y en el uso de RTX.
Recomendaciones en las guías AEEH, EASL y AASLD
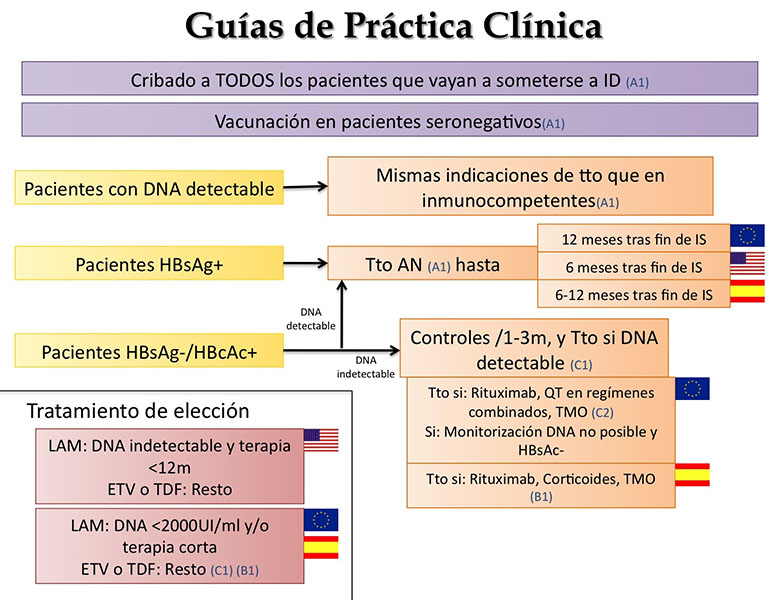
En la Figura 4, se exponen las recomendaciones de las guías más comúnmente utilizadas (AEEH 2012, EASL 2012 y AASLD 2009), entre las que, como se puede comprobar, hay sólo sutiles diferencias[60]-[62]. En la última actualización de las guías AASLD (Noviembre 2015), no se aborda el manejo de los pacientes inmunosuprimidos[63].
En resumen:
- Los pacientes previamente no expuestos han de vacunarse.
- Los pacientes con hepatitis crónica activa han de seguir las recomendaciones de tratamiento generales.
- Los portadores asintomáticos e infecciones ocultas recibirán tratamiento profiláctico en función de la IS recibida (riesgo moderado, alto o muy alto)
- Los pacientes con serología de VHB pasada con carga indetectable recibirán tratamiento profiláctico sólo ante situaciones de mayor riesgo.
El tratamiento de elección será un AN de 3ª generación y se reservará la Lamivudina a cursos de IS menores al año en pacientes con DNA bajo.
Los pacientes sin indicación de tratamiento serán monitorizados con DNA mensual/trimestral.
Eficacia del cribado en la práctica clínica
A pesar de que, como se ha comentado, la posibilidad de que se produzca una reactivación pasa a ser remota aplicando la profilaxis antiviral en los pacientes seleccionados, diferentes estudios ponen de manifiesto un déficit en el adecuado cumplimiento de los algoritmos propuestos.
El cribado del VHB en los pacientes sometidos a IS ha de ser universal, pero en encuestas telefónicas a especialistas que manejan estas terapias en nuestro país, un 35% admitió que nunca o sólo a veces solicitaba la serología[64]. En estudios similares en otros países, se evidencia un cumplimiento del screening que no alcanza en muchos casos el 25%[65]-[66].
Sun W-C y cols publicaron los resultados de la aplicación del cribado tras la implantación de alertas informáticas al prescribir fármacos IS en Taiwan. Si bien éstos eran alentadores en cuanto a la mejoría de cumplimiento del screening serológico, la administración del tratamiento en pacientes de riesgo igualmente no superó el 50% en tumores sólidos[67], lo que demuestra que tan importante como la universalización del cribado es el desarrollo de algoritmos claros de derivación, tratamiento y vigilancia.
El mayor reto para los gastroenterólogos, por tanto, en el momento actual, es colaborar estrechamente con las especialidades implicadas para encontrar la estrategia que contribuya al máximo cumplimiento del cribado, minimizando así el número de casos de reactivación y de suspensiones de terapia.