CORRESPONDENCIA
Unidad de Gestión Médico-Quirúrgica de Enfermedades Digestivas y ciberehd. Hospital Universitario de Valme. Universidad de Sevilla. 2ª planta.
Avenida de Bellavista s/n. 41014 Sevilla.
Teléfono: 0034955015761
mromerogomez@us.es
Introducción
La encefalopatía hepática (EH) es un disturbio potencialmente reversible, de causa metabólica, que ocurre en pacientes con enfermedad hepática aguda o crónica, y que consiste en una alteración del funcionamiento del sistema nervioso central. La EH se clasifica según los criterios de West Haven, los cuales son ampliamente aceptados[1]. Entre el 30%-50% de pacientes cirróticos que no muestran síntomas de EH clínica presentan encefalopatía hepática mínima (EHM)[2]. Se trata del primer paso en el espectro de la EH. Se define como la presencia de defectos cognitivos en pacientes con enfermedad hepática, los cuales no son detectados en la exploración clínica o neurológica habitual. EHM se caracteriza, además de por déficit cognitivo, por enlentecimiento motor, defectos en la atención y percepción visual, y alteración en los movimientos finos (destreza manual). Por otro lado, predice la probabilidad de encefalopatía hepática y la capacidad de supervivencia en pacientes con cirrosis hepática[3].
Patogénesis
Durante años, la hiperamonemia ha sido la principal explicación de la patogenia de EH. Sin embargo, en la última década, han emergido factores coexistentes en el desarrollo de EH, como son el incremento de la respuesta inflamatoria sistémica o la hiponatremia.
El amonio se produce, principalmente, por la deaminación de la glutamina por la glutaminasa (GLS) en los enterocitos del intestino delgado y colon, así como a través de la hidrólisis de urea por las bacterias que están en el intestino. Tal es así, que la actividad intestinal de la GLS se ha observado más alta en pacientes cirróticos que en controles sanos[4]. En condiciones normales, el hígado elimina el amonio a través del ciclo de la urea, pero en la cirrosis hepática, la detoxificación del amonio tiene lugar en el músculo a partir de la síntesis de glutamina (por la enzima glutamina-sintetasa), de ahí el relevante papel del músculo y, por tanto, de la nutrición en el paciente cirrótico. Se han descrito tres isoformas distintas de la GLS: la tipo renal (KGLS), que se encuentra expresada en varios tejidos del organismo; la tipo hepática (LGLS), llamada así porque fue identificada originalmente en los hepatocitos; y la tipo C (CGLS), que se encuentra presente en las células mononucleares periféricas. Los astrocitos son las únicas células capaces de metabolizar el amonio en el cerebro. Poseen, en el retículo endoplasmático, glutamina-sintetasa que se encarga de convertir el glutamato y el amonio en glutamina que, al ser osmóticamente activa, provoca la entrada de agua en el astrocito, generando edema[5]. Este edema cerebral de bajo grado, que se relaciona sobre todo con la EH tipo C, es compensado por la liberación de mioinositol (mecanismo homeostático)[6].
Por otro lado, existe una evidencia creciente sobre el papel que juega la respuesta inflamatoria sistémica en la EH. La patofisiología de la EH está íntimamente relacionada con cambios en la barrera hemato-encefálica, de la que las células endoteliales y los astrocitos son sus principales constituyentes. Durante la infección, las células de la microglía se activan y los astrocitos adquieren la habilidad de liberar citoquinas proinflamatorias (IL-6, TNFα), las cuales son capaces de exacerbar las alteraciones neuropsicológicas inducidas por la propia hiperamonemia. Se ha observado que los niveles de TNFα están más elevados en pacientes con cirrosis que en sujetos sanos, habiéndose demostrado además una correlación positiva entre sus niveles y la severidad de EH[7]. Otra característica de TNFα es que influye en la permeabilidad de la barrera hemato-encefálica, lo cual favorece la difusión del amonio[8]. De una manera similar, los niveles séricos de IL-6 se correlacionan con la presencia de EHM y su severidad[9], así como con la modulación de la función cognitiva[10].
En este contexto, la diabetes mellitus (DM) y la resistencia a la insulina (RI) podrían tener una especial relevancia en la patogenia de la EH. En primer lugar, DM parece ser capaz de modular GLS. Watford et al. observaron que la actividad de la GLS estaba incrementada en riñón, hígado e intestino delgado de ratas diabéticas. Concretamente, la capacidad del intestino delgado para catabolizar glutamina fue 10 veces superior a lo normal, debido a un aumento del tamaño de este órgano (lo cual es típico de DM)[11]. Además, KGLS y LGLS están presentes en el páncreas endocrino (células α y β, respectivamente), por lo que el sistema glutamatérgico podría alterar la secreción de insulina y glucagón[12]. En segundo lugar, DM y RI se caracterizan por la liberación de citoquinas proinflamatorias, particularmente TNFα y IL-6, lo que resulta en un incremento de la respuesta inflamatoria sistémica[13]. En tercer lugar, la resistencia a las acciones de la insulina podría promover e incrementar el catabolismo proteico y, finalmente, la producción de amonio. Esto es debido a que la insulina es capaz de estimular la síntesis e inhibir la degradación proteica en tejidos periféricos. Por último, la DM se acompaña con frecuencia de neuropatía autonómica, lo que supone un enlentecimiento del tránsito intestinal, provocando estreñimiento y aumento de la translocación bacteriana[14], siendo éstos precipitantes de EH bien conocidos.
Importancia clínica
Son varios los estudios que han asociado la EHM con una disminución de la supervivencia[15] y un empeoramiento en la calidad de vida. Aunque existe un consenso general sobre el efecto directo de la EH sobre la calidad de vida, la alteración neuropsicológica impide, en ocasiones, que estos pacientes puedan completar los cuestionarios rutinarios de calidad de vida[16], lo que dificulta su estudio. Entre las afecciones de la calidad de vida estudiadas, destacan la presencia de caídas y de accidentes de tráfico.
Las caídas son especialmente importantes en los pacientes cirróticos, ya que el riesgo de fracturas es superior a la población normal debido a la mayor prevalencia de osteoporosis (malnutrición, hipogonadismo, insuficiencia hepática), lo que supone un aumento de la morbi-mortalidad[17]. Román et al., llevaron a cabo un estudio retrospectivo en el que compararon el porcentaje de caídas entre cirróticos con EHM (40%), cirróticos sin EHM (12.9%) y controles (11.6%), observando diferencias significativas[18]. En el único estudio prospectivo publicado hasta la fecha, los pacientes con deterioro cognitivo (diagnosticado por test psicométricos) mostraron un 40% de caídas, porcentaje muy superior al 6% de los pacientes sin EHM; con otro dato significativo, y es que más de la mitad de los pacientes con EHM presentaron caídas importantes durante el año del seguimiento[19]. Una posible hipótesis que explicaría estos resultados sería la presencia del parkinsonismo asociado a cirrosis. Sin duda, estos datos nos deberían obligar al despistaje precoz de EHM.
Por otro lado, la atención prestada a la relación entre la EHM y la conducción está más que justificada, ya que los accidentes de vehículos de motor se asocian tanto a una considerable morbi-mortalidad, como a un gran coste socio-económico. Esta relación se sustenta en los déficits de atención, visuales y motores asociados a esta condición[20]. Wein et al., observaron que los pacientes con EHM requieren más intervenciones para prevenir accidentes que los pacientes con cirrosis sin EHM[21]. Resultados similares se obtuvieron después, ya que pacientes con EHM presentaron un 16% de accidentes de tráfico, frente al 4% de los que no la tienen[22]. Bajaj et al. recientemente han publicado un estudio donde comparan los costes estimados de los accidentes de conducción en pacientes con EHM y los costes derivados de su diagnóstico precoz y manejo. Sus resultados sugieren que el cribaje de EHM mediante un test computerizado (Inhibitory Control Test (ICT)), y el tratamiento de los pacientes diagnosticados con lactulosa puede ser una estrategia válida y coste-efectiva[23].
Diagnóstico
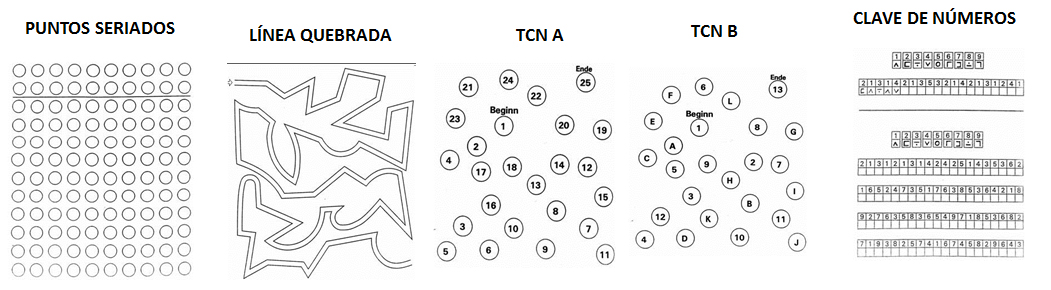
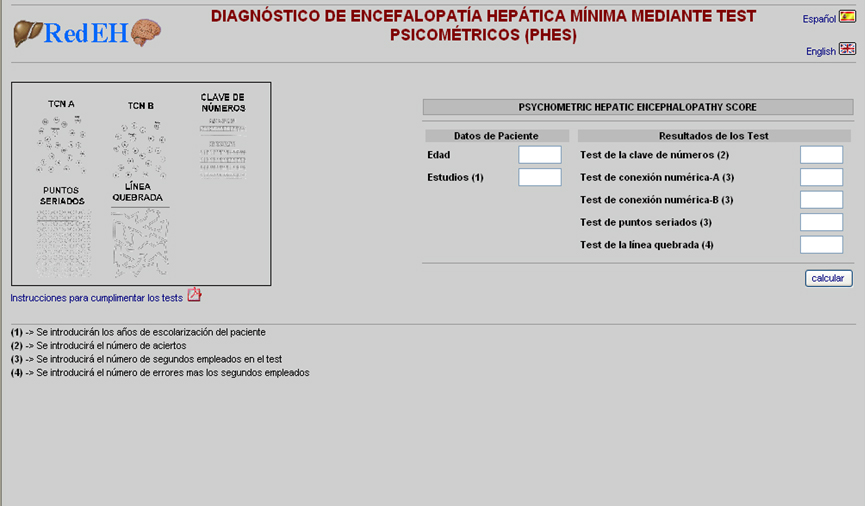
El diagnóstico de EH es fundamentalmente clínico, mientras que para la EHM no se ha establecido, de manera definitiva, un test standard. La mayoría de estudios se basan en el uso de pruebas psicométricas, como herramienta simple y barata para su diagnóstico[24]. PHES (Psychometric Hepatic Encephalopathy Score) combina cinco test psicométricos (digit symbol test (DST), number connection test-A (NCT-A), number connection test-B (NCT-B), serial dotting test (SDT) y line tracing test (LTT)) cuya puntuación oscila entre -15 y +3, siendo el límite que define la existencia de EH incipiente -4 puntos[25] (Figura 1). PHES puede ser usado para detectar la mayoría de alteraciones neuropsicológicas relacionadas con EHM, ya que evalúa la velocidad y precisión del movimiento, la percepción visual, la orientación espacial, la concentración, la atención y la memoria[26]. Sin embargo, los resultados de los tests psicométricos (incluyendo PHES) están influidos por diversos factores como la edad, el sexo o el nivel educativo, además de la capacidad de aprendizaje (lo que limita su repetibilidad). Por tanto, pueden diferir según la población a estudio y por ello no terminan de ser definitivos (Figura 2).
Tabla 1
Figura 2
Corrección de los test psicométricos para el diagnóstico de la encefalopatía hepática mínima según las tablas de normalidad de la población española.
Existe otro grupo de pruebas, clasificadas como neurofisiológicas, que aportan una cierta objetividad aunque en ocasiones pueden presentar problemas metodológicos, ser poco accesibles, requerir aparataje sofisticado o un análisis especializado. La medición de la frecuencia crítica de parpadeo (FCP) se ha mostrado útil en el diagnóstico de la EHM[27]. Es una prueba fácil de realizar y rápida de realizar. El fundamento es que las células de la retina muestran una alteración similar (edema) a los astrocitos cerebrales. Consiste en pulsar un botón cuando el paciente nota que existe parpadeo en un punto luminoso en el interior de unas gafas cerradas. El punto de corte se sitúa en 39 HZ, de manera que valores superiores se consideran normales y valores inferiores, patológicos (FCP desciende conforme se agrava la EH). Además, la FCP alterada predice de forma independiente el riesgo de encefalopatía hepática clínica y es capaz de predecir el pronóstico y supervivencia de los cirróticos[28]. Finalmente, presenta la ventaja de no estar influido por la edad ni por el nivel educativo y no presenta fenómeno de aprendizaje[29]. Por otro lado, la electroencefalografía es una herramienta útil, ya que los pacientes con EH muestran una actividad eléctrica cerebral disminuida, aunque presenta una sensibilidad muy variable (43%-100%) según el estudio[30].
La resonancia magnética (RM) podría jugar un papel importante ya que muestra cambios patológicos en pacientes con EHM. Se detecta una señal hiperintensa bilateral y simétrica a nivel de los ganglios basales (globo pálido y sustancia negra) en las imágenes potenciadas en T1, lo cual podría estar en relación con depósitos de manganeso[31] (cuya presencia se ha asociado a la aparición de síntomas parkinsonianos[32]). El incremento de amonio cerebral y el estrés osmótico derivado de éste, pueden objetivarse in vivo mediante espectroscopia por RM que, de forma casi constante, muestra un aumento de la glutamina y una disminución de mioinositol (metabolito que, como hemos visto, actúa como regulador osmótico)[33] .
Por último, recientemente ha sido descubierto un biomarcador periférico que es un buen indicador de presencia de EHM, como es la 3-nitro-tirosina. En el estudio realizado por Montoliú et al., este biomarcador mostró una sensibilidad de 89%, una especificidad de 93% y valor predictivo positivo y negativo de 91%, observando un fuerte incremento en sus valores en individuos con EHM[34]. Como consecuencia, la determinación de esta molécula permitiría extender el diagnóstico más allá de los hallazgos clínicos.
Tratamiento
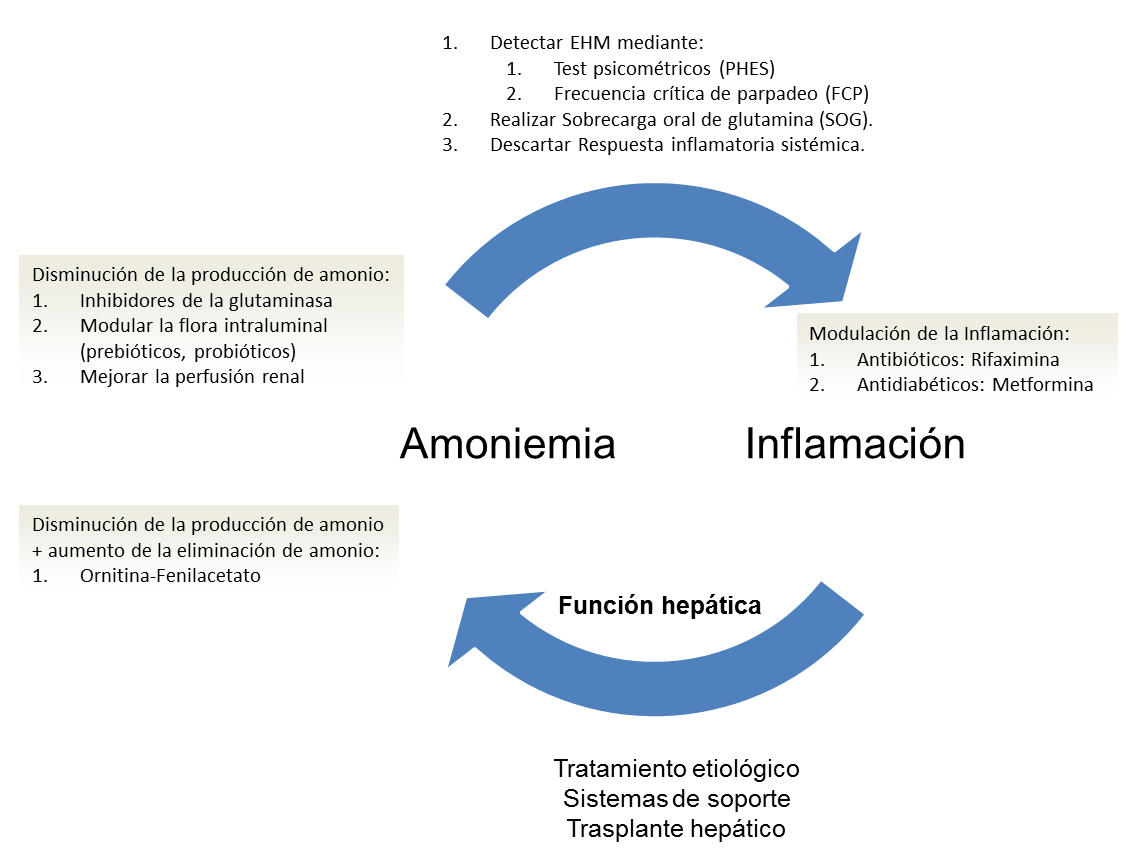
Existen una serie de medidas generales a tener en cuenta: identificar y corregir las causas desencadenantes; descartar otras causas de alteración mental en pacientes cirróticos; descartar hemorragia digestiva o infecciones; y retirada de fármacos hipnóticos o diuréticos. En cuanto a las medidas específicas, van encaminadas hacia la disminución de la producción de amonio o al aumento de su eliminación (Figura 3).
Disacáridos no absorbibles
La lactulosa (ß-galactosido-fructosa) y el lactitol (ß-galactosido-sorbitol) son los tratamientos de los que existen más datos, ya que han sido usados en práctica clínica desde hace tiempo. En consecuencia, se consideran de primera elección en el tratamiento de la EH. La eficacia clínica de lactulosa y de lactitol es la misma, sin embargo lactitol parece ser tolerado mejor, debido a un mejor sabor y a que produce menos meteorismo La lactulosa es metabolizada por las bacterias colónicas en ácido acético y ácido láctico, los cuales acidifican el medio (reduciendo el pH) y, por consiguiente, impiden el crecimiento de las bacterias productoras de amonio. Este efecto acidificador se suma a su efecto catártico y laxante (eliminando otro posible desencadenante, como es el estreñimiento) y a la reducción de consumo de glutamina en la pared intestinal. La lactulosa se ha mostrado efectiva en mejorar la calidad de vida en pacientes con EHM, evaluada por test psicométricos[35]. Recientemente, se ha publicado un metaanálisis en el que se confirma los efectos beneficiosos de la lactulosa en pacientes con EHM frente a placebo o no intervención (mejoría en test psicométricos, en evitar progresión a EH y en niveles de amonio, no así respecto a mortalidad)[36]. Respecto a EH, en 2004 una revisión de la Cochrane concluyó que los estudios hasta la fecha no tenían la calidad suficiente para recomendar su uso[37]. Posteriormente, se ha mostrado superior a placebo en la prevención de EH (19.6% vs 46.8%)[38] . Por último, parece ser también eficaz en la profilaxis secundaria de EH[39]. La dosis empleada es 15ml-60 ml dos o tres veces cada 24 horas, hasta conseguir 2-3 deposiciones blandas al día. Estos fármacos presentan escasos efectos secundarios: los más comunes son la alteración de la percepción del gusto y el meteorismo.
Antibióticos
Determinados antibióticos han sido útiles en la disminución de los niveles plasmáticos de amonio. El objetivo de su uso es reducir la producción de amonio en el intestino, eliminando las bacterias con actividad ureasa (además de disminuir la translocación bacteriana y la respuesta inflamatoria sistémica). El primero utilizado fue la neomicina, que actúa uniéndose a la unidad 30s del ribosoma e inhibe la síntesis proteica. A pesar de su baja absorción (4%), los macrólidos no representan la mejor opción, debido a su ototoxicidad y nefrotoxicidad (incrementadas en pacientes con mala función hepática). El metronidazol se ha mostrado tan eficaz como la neomicina[40], pero su elevada absorción y su neurotoxicidad, junto con su metabolismo hepático (lo que incrementa el riesgo de toxicidad en enfermedad hepática) hacen inadecuado su uso.
La rifaximina se ha postulado como la mejor alternativa. Se trata de un antibiótico oral de amplio espectro (bacterias GRAM+ y GRAM-, aerobias y anaerobias) y escasamente absorbible (<0.4%), lo que dificulta la aparición de efectos secundarios y de resistencias. La rifaximina se une a la subunidad β de la ARN-polimerasa, por lo que inhibe el ADN bacteriano y la síntesis proteica. Una importante ventaja es su rapidez de acción, ya que ocasiona una disminución importante de la flora bacteriana pocos días después de iniciar su uso. La rifaximina mejora los resultados de los test psicométricos, la calidad de vida[41] y la habilidad en la conducción de pacientes con EHM[42]. Bass et al. evaluaron la eficacia de la rifaximina (frente a placebo) en la prevención de EH, en pacientes que habían presentado más de dos episodios en los últimos seis meses. La dosis administrada fue de 550mg cada 12 horas durante 6 meses. La rifaximina se mostró más eficaz en el mantenimiento de la remisión y redujo significativamente el riesgo de hospitalización[43]. Sin embargo, no influyó en la calidad de vida ni en los índices de supervivencia. Este antibiótico ha sido comparado en diversos estudios con lactulosa, mostrándose más fiable en la mejora de signos y síntomas de EH[44]. Por tanto, la rifaximina se muestra como una buena opción, en comparación a otros antibióticos o disacáridos no absorbibles, consiguiendo una mejoría clínica rápida con un buen perfil de seguridad y tolerancia. A pesar de que la dosis diaria de rifaximina es más cara que el lactitol, la reducción de hospitalizaciones y la disminución de la estancia media hacen que, a la larga, el tratamiento con rifaximina sea más coste-efectivo[45]. Actualmente, se recomienda tratamiento de 400mg cada 8 horas durante, al menos, seis meses.
Probióticos
Los probióticos son microorganismos vivos, no patogénicos, que están presentes en la comida y modifican la flora bacteriana intestinal (promueven la colonización de bacterias sin actividad ureasa), lo que se traduce en una mejora de la respuesta inflamatoria y en una reducción de la producción intestinal de amonio. Son muy bien tolerados y su índice de complicaciones es excelente. Un ejemplo es VSL#3®, formado por cuatro cepas de Lactobacillus (L. paracasei, L. plantarum, L. acidophilus y L. delbrueckii subsp. bulgaricus), tres de Bifidobacterium (B. longum, B. breve y B. infantis) y una cepa de Streptococcus thermophilus. Se ha observado como son capaces de alterar la producción de ácidos grasos de cadena corta, de mejorar la escala de Child-Pugh y de disminuir el nivel de endotoxinas en pacientes cirróticos[46]. En 2011, una revisión de la Cochrane concluyó que los probióticos reducían la concentración de amonio, mientras que su efecto real en la clínica no estaba tan claro[47] . Se ha comprobado su eficacia en la mejoría de EHM y en la disminución de episodios de EH durante el seguimiento[48], mientras que los datos sobre el tratamiento del episodio de EH y la profilaxis secundaria son escasos.
Terapia nutricional
La ingesta proteica ha sido sometida a gran debate durante los últimos años. En un principio, se entendía que el exceso de proteínas provocaba un incremento en los niveles de amonio. Hoy en día se acepta que la reducción de la ingesta proteica disminuye la masa muscular y, por tanto, la capacidad de absorber amonio fuera del hígado (en pacientes cirróticos, la mayoría del amonio es eliminado desde el músculo). Córdoba et al. observaron que la restricción de proteínas no mejoraba la evolución clínica de la EH[49]. Actualmente, la European Society for Clinical Nutrition and Metabolism recomienda la ingesta de proteínas de 1-1.2g/kg de peso al día para pacientes con EH, preferentemente con proteínas de origen vegetal (por tener menos aminoácidos aromáticos, que empeoran EH)[50].
El estado nutricional puede beneficiarse mediante la ingesta de aminoácidos de cadena ramificada (valina, leucina, isoleucina). El grupo amino de estos aminoácidos se utiliza para formar glutamato y para detoxificar amonio, a través de la producción de glutamina (vía glutamina sintetasa). En concreto, la leucina disminuye la degradación muscular, lo cual (según hemos visto) es crucial en pacientes con disfunción hepática. Se ha observado una mejora los resultados de test psicométricos en pacientes con EH[51]. Otros estudios han concluido que los aminoácidos ramificados reducen el riesgo de muerte y atenúan la progresión del daño hepático en la cirrosis[52]. No obstante, los estudios realizados son difícilmente comparables y no permiten establecer recomendaciones claras al respecto.
La L-ornitina-L-aspartato (LOLA) estimula el ciclo de la urea y la síntesis proteica en el músculo. Ambas moléculas, al producir glutamato, activan la síntesis de glutamina y la detoxificación de amonio. Puede ser administrada de forma oral o intravenosa (más efectiva pero menos segura). Se ha mostrado superior a placebo en mejorar la capacidad mental y en disminuir la hiperamonemia[53]. En concreto, en pacientes con EHM que recibieron durante tres meses LOLA, el 35% se recuperaron[54]. Estos resultados han sido refrendados en un metaanálisis, que evaluó la utilidad de LOLA en la EH, concluyendo su utilidad en los grados I y II, no así en los III y IV[55]. El tratamiento consiste en 6g de dosis oral tres veces al día. Por su parte, la L-ornitina-fenilacetato es un fármaco más novedoso. La L-ornitina (componente activo de LOLA) estimula la síntesis de glutamina en el músculo, mientras que el fenilacetato excreta la glutamina, dependiente de la L-ornitina, por la orina. Hasta la fecha, sólo se han realizado estudios con animales, siendo satisfactorios (aunque hay estudios en fase II para evaluar el perfil de seguridad y tolerabilidad).
Metformina
La metformina es un antidiabético oral del grupo de las biguanidas. Disminuye la hiperglucemia fundamentalmente a través de la inhibición de la gluconeogénesis hepática (a través de la activación de AMPK), disminuye la absorción de glucosa intestinal y aumenta la sensibilidad a insulina en tejidos periféricos. Además, modula la expresión de citoquinas proinflamatorias, como TNFα y IL-6[56]. Nuestro grupo evaluó el impacto de metformina en pacientes cirróticos (con DM tipo 2) sobre la encefalopatía hepática y sobre la actividad de la glutaminasa, mediante la producción de amonio en células Caco2. Los resultados fueron esperanzadores, ya que los individuos con metformina mostraron un 4.9% de EH, frente al 41.5% de los que no la tomaron. Además, los pacientes tratados con metformina mostraban un nivel menor de TNFα, sin significancia estadística. Por último, obtuvimos una inhibición parcial de la actividad de la glutaminasa, en concreto un 25% con una dosis de 20mM de metformina.