Introducción
Abreviaturas:
CH: cirrosis hepática
ET: elastografía de transición
GPVH: gradiente de presión venoso hepático
HC: hepatopatía cónica
HTP: hipertensión portal
HTPCS: hipertensión portal clínicamente significativa
IR: índice de resistencia
IP: índice de pulsatilidad
Vp: velocidad portal
VE: vena esplénica
VMS: vena mesentérica superior
VSH: venas suprahepáticas
La CH (CH) representa el estadio final de las hepatopatías crónicas y supone un grave problema de salud pública con alrededor de 800.000 muertes al año en todo el mundo[1]. Se define histológicamente por la presencia de una alteración difusa de la arquitectura hepática por fibrosis y nódulos de regeneración, que acompañada de distorsión vascular intrahepática y una reducción de la masa funcional, genera hipertensión portal (HTP) e insuficiencia hepatocelular. El término de CH silente o compensada se aplica cuando la enfermedad no ha desarrollado ninguna de sus complicaciones mayores: ascitis, hemorragia digestiva, ictericia y encefalopatía hepática. Por consiguiente, el diagnóstico de una hepatopatía crónica (HC) en estadio cirrótico implica un cambio en el manejo y pronóstico de la enfermedad, ya que estos pacientes deben ser sometidos a una vigilancia más estrecha, que incluye el cribado de varices esofágicas y hepatocarcinoma, y a medidas terapéuticas específicas que prevengan la progresión de la enfermedad[2], [3].
La biopsia hepática es el procedimiento diagnóstico de elección para determinar la severidad de la fibrosis y el estadio evolutivo de la HC[4]. No obstante, se trata de una técnica poco aceptada por el paciente, requiere ingreso hospitalario, no está exenta de complicaciones (morbilidad del 3% y mortalidad del 0,03%) y no es útil en el seguimiento de la enfermedad. Además, la interpretación de la biopsia se ve limitada por la variabilidad intra e interpersonal, en función del adiestramiento, la dedicación y sobre todo del tamaño de la biopsia, así como por el error muestral, que infraestima la CH en un tercio de los casos[5]-[7].
El procedimiento de elección para evaluar la presencia y severidad de la HTP es la determinación del GPVH (gradiente de presión venoso hepático) mediante cateterismo de las VSH (venas suprahepáticas). No obstante, al igual que ocurre con la biopsia hepática se trata de un método invasivo, que además requiere material y personal especializado. El desarrollo de HTP clínicamente significativa (HTPCS) es un evento clave en la evolución de la HC ya que el desarrollo de ascitis y de varices esofágicas se produce cuando el GPVH supera los 10 mm Hg[8].
Todos estos datos han motivado el interés por el desarrollo de procedimientos no invasivos para la detección de CH e HTPCS.
La ultrasonografía convencional (modo B y doppler) se considera por su inocuidad, bajo coste, accesibilidad y rendimiento diagnóstico, la técnica de imagen de primera línea en la valoración inicial de los pacientes con sospecha o evidencia de enfermedad hepática y/o en el seguimiento de las enfermedades hepáticas difusas y sus complicaciones. La aplicación de nuevas tecnologías a la ultrasonografía nos ha permitido estimar la fibrosis hepática a través de la medición de la rigidez hepática y estudiar la perfusión hepática mediante la inyección de contrastes ecográficos.
A continuación repasaremos el papel de la ecografía abdominal como técnica de imagen no invasiva en el diagnóstico de la hepatopatía difusa crónica y sus complicaciones.
ECOGRAFÍA ABDOMINAL EN MODO B Y DOPPLER
1.1. SIGNOS DIRECTOS DE HC
1.1.1. Cambios en la morfología hepática
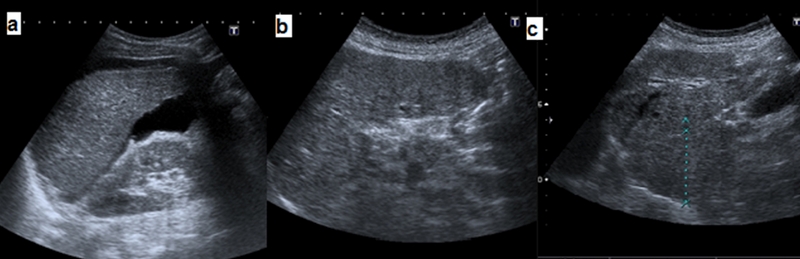
Los cambios acontecidos en la microcirculación hepática como consecuencia del desarrollo de fibrosis y nódulos de regeneración provocan disfunción hepatocitaria y atrofia. A medida que la HC avanza se produce una atrofia de los segmentos posteriores del lóbulo hepático derecho (segmentos VI y VII) y una hipertrofia del segmento lateral del lóbulo hepático izquierdo (segmentos II y III) y del caudado[9] (Figura1). Un diámetro anteroposterior del lóbulo caudado >3,5 cm tiene una sensibilidad del 52% y una especificidad del 91% en el diagnóstico de CH silente[56], [78]-[80].
Figura 1
Alteraciones morfológicas en la cirrosis hepática. a) atrofia del lóbulo hepático derecho b) hipertrofia del lóbulo hepático izquierdo c) hipertrofia del caudado.
1.1.2. Nodularidad de los bordes
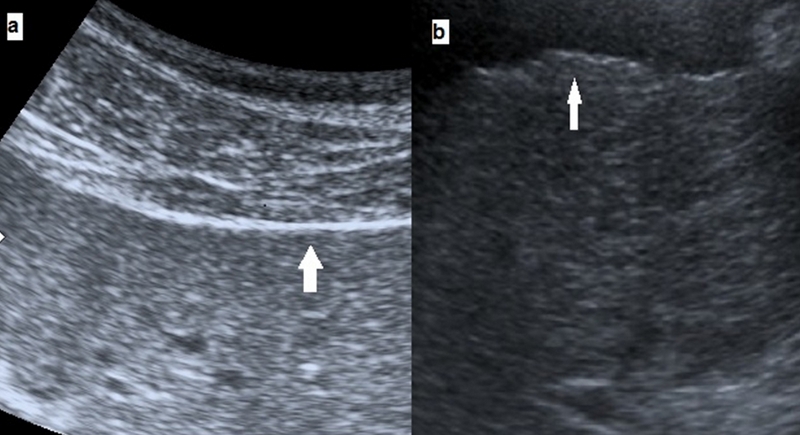
La superficie hepática nodular refleja la presencia de septos fibróticos y nódulos de regeneración. Se hace más evidente en la interfase del hígado con la vesícula biliar y en la zona adyacente al riñón derecho, en el borde posterior del lóbulo izquierdo y en la posición más cercana al transductor. Este signo se considera positivo cuando en vez de una línea hiperecogénica continua y recta encontramos una superficie hepática irregular y discontinua (Figura 2). Es el signo ecográfico aislado más preciso en el diagnóstico de CH y puede estar presente incluso en fases muy precoces de la enfermedad. Este hallazgo tiene una sensibilidad variable en los estudios existentes, siendo las causas de los falsos negativos la cirrosis micronodular (nódulos < 3 mm), el uso de transductores de baja frecuencia y la subjetividad del explorador. La especificidad media es del 88% (82-95%), siendo el hígado tumoral y la hiperplasia nodular las causas más frecuentes de los falsos positivos. Con el uso de sondas lineales de alta frecuencia para la valoración de los bordes hepáticos Simonovský diagnosticó CH con una sensibilidad y especificidad de 91% y 93%, respectivamente[10], [73]-[75].
Figura 2
a) bordes lisos en un hígado sano b) bordes irregulares y discontinuos en un paciente con cirrosis hepática.
1.1.3. Cambios en la ecogenicidad del parénquima
A medida que la enfermedad avanza la ecoestructura hepática se torna hiperecoica y el grano se engruesa hasta adoptar en fases avanzadas un aspecto heterogéneo de nodularidad grosera. Este signo ecográfico está sujeto a una gran dependencia del operador y del ecógrafo, especialmente en sus estadios intermedios[76], [77]. No obstante, en el modelo de Cádiz, la alteración de la ecoestructura hepática fue el mejor predictor de la presencia de CH[55]. Es importante que diferenciemos la fibrosis de la esteatosis hepática, si bien en ocasiones pueden coexistir. En ambos casos el parénquima hepático es hiperecoico, pero mientras la esteatosis atenúa el sonido en los campos posteriores y da lugar a un grano fino y homogéneo, la fibrosis engruesa el grano de forma progresiva y anárquica, sin atenuar el sonido (Figura 3).
Figura 3
Hígado hiperecogénico, de grano medio y sin atenuación del sonido (fibrosis) en un paciente con hepatitis crónica por virus C.
1.1.4. Cambios en la morfología y el patrón de flujo de las VSH
En general, las VSH se distorsionan paulatinamente por el desarrollo de fibrosis y nódulos de regeneración, tornándose irregulares y afiladas. Recientemente Vessal y col. han demostrado que la valoración de los bordes de la pared de las VSH en un plano perpendicular al vaso (rectos, irregulares, muy irregulares) muestra una sensibilidad y especificidad en el diagnóstico de CH del 97% y del 91%, respectivamente[11].
El flujo de las VSH en individuos sanos muestra un patrón Doppler trifásico que traduce las variaciones del ciclo cardíaco (periodicidad): fase anterógrada (hepatófuga) con dos ondas negativas que coinciden con la diástole atrio-ventricular y otra más corta, positiva y retrógrada, durante la sístole atrial. En los pacientes con HC se produce un aplanamiento progresivo de la onda de flujo de las VSH. La fibrosis hepática provoca una disminución de la distensibilidad de la pared de las VSH (componente mecánico) y el posterior desarrollo de HTP contribuye a aplanar la onda, al amortiguar los cambios hemodinámicos derivados de la presión venosa central (componente dinámico).
La clasificación morfológica del patrón de flujo de las VSH es una técnica más fácil de realizar, reproducible y probablemente más precisa que el cálculo de índices cuantitativos del flujo hepatófugo de cada fase respiratoria. Bolondi y col. clasificaron el patrón doppler de las VSH en tres tipos: HV0, para el patrón trifásico normal; HV1 cuando hay una alteración de las oscilaciones normales, no observándose la fase de flujo retrógrado; HV2 si se pierden las oscilaciones normales y el flujo es totalmente plano[12]. El flujo aplanado de las VSH se correlaciona con una función hepática más deteriorada y con HTP severa[13].
1.2. SIGNOS DE HTP O INDIRECTOS DE HC
1.2.1. Signos directos
1.2.1.1. Dilatación y pérdida de la fasicidad de la vena esplénica (VE) y/o mesentérica superior (VMS).
La determinación del calibre de la VE y/o de la VMS puede ser de utilidad cuando la porta es de calibre normal o no se visualiza, pero en realidad hay pocos datos acerca de los valores de corte útiles y de su precisión. Más rentable resulta la ausencia de modificación del calibre de estas venas con los movimientos respiratorios, ya que un cambio menor del 50% supondría en el adecuado contexto clínico un signo de HTP incipiente[84], [85].
1.2.1.2. Dilatación portal.
El eje esplenoportomesentérico se encuentra dilatado en la CH como consecuencia de la resistencia al flujo hepático. El grupo de Cádiz ha demostrado en un estudio prospectivo que una porta mayor de 12 mm tiene una sensibilidad del 53% y una especificidad del 97% en el diagnóstico de CH silente55. La medida se debe realizar antes de la entrada del vaso en el parénquima hepático y a distancia de la confluencia esplenomesentérica, generalmente donde se cruza la arteria hepática[81], [82].
1.2.1.3. Circulación colateral
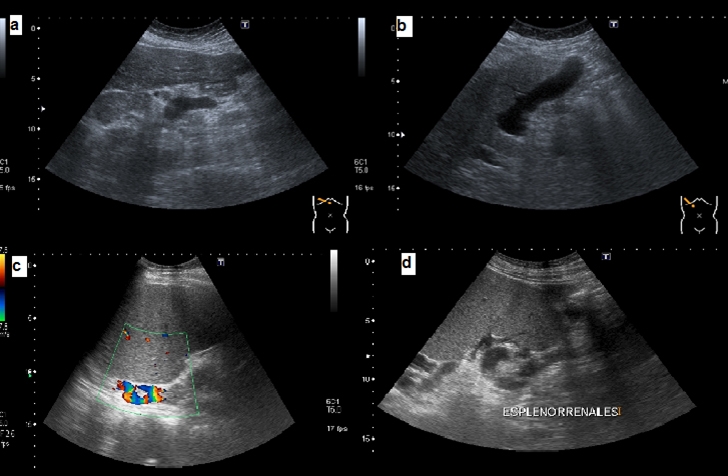
La circulación colateral es un signo ecográfico específico (100%) de HTPCS, pero su prevalencia en los pacientes con CH es muy variable (15-80%) y es poco frecuente en la enfermedad silente[87]. Debe ser buscada sistemáticamente, siendo las vías más frecuentes la paraumbilical y gástrica izquierda. Otras colaterales a explorar son las esplenorrenales y gástricas cortas en el hilio esplénico y varices císticas en la pared vesicular (Figura 4).
Figura 4
Circulación colateral. a) gástrica izquierda b) paraumbilical c) gástricos cortos d) esplenorrenal
- La gástrica izquierda se visualiza por detrás del lóbulo hepático izquierdo saliendo del eje en dirección al esófago. En sujetos sanos y delgados no es infrecuente demostrar una gástrica izquierda menor de 5 mm de flujo hepatópeto, mientras en la HTP muestra un flujo hepatófugo, significativo cuando su velocidad media (Vm) supera los 12 cm/seg y con elevado riesgo de sangrado por rotura de varices esofágicas si excede los 15 cm/seg[14], [15].
- La vena paraumbilical discurre desde la porta izquierda, alrededor del ligamento redondo hasta el falciforme con dirección al ombligo. Aparece en el 15-42% de los pacientes con CH. Se considera signo de HTP cuando su calibre excede de 3 mm y su flujo es hepatófugo, ya que una vena paraumbilical permeable de 2 mm con velocidad inferior a 5 cm/seg se puede observar en sujetos sanos[16], [17]. Cuando el calibre es mayor de 6 mm y la velocidad mayor que la portal es rara la coexistencia de varices esofágicas y frecuente la encefalopatía hepática[18].
- En el hilio esplénico podemos encontrar vasos de circulación colateral dependientes de la VE. La demostración de gástricos cortos en el polo superior esplénico nos obliga a descartar mediante endoscopia la presencia de varices fúndicas. Los vasos esplenorrenales son los más prevalentes en pacientes con encefalopatía hepática y en aquellos con inversión del flujo portal, situándose en el polo inferior esplénico junto al riñón izquierdo.
1.2.1.4. Inversión portal
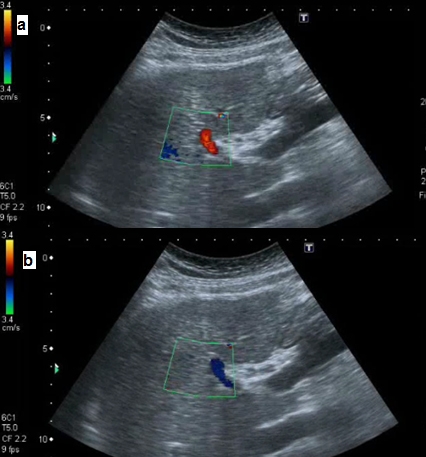
Salvo excepciones, la inversión del flujo portal en el tronco principal y/o en sus tributarias esplácnicas es un signo específico de HTP que acontece en el 3-23% de los pacientes con CH. La presencia de shunts arterio-portales intrahepáticos provoca que el flujo en las ramas y el tronco principal de la porta se invierta y drene a la circulación sistémica a través de vasos colaterales (podrían ser esplenorrenales). Cuando la inversión del flujo se produce exclusivamente a nivel del eje esplenoportomesentérico (sin afectar al tronco principal portal) suele deberse a la presencia de vasos colaterales esplenorrenales[19]. La existencia de un flujo portal alternante (hepatópeto en inspiración y hepatófugo en espiración) es también un signo de HTP (Figura 5).
Figura 5
Flujo alternante (doppler color) en la porta izquierda a) Inspiración: flujo hepatópeto b) Espiración: flujo hepatófugo.
1.2.2. Signos indirectos de HTP
1.2.2.1. Esplenomegalia
Es el signo que más frecuentemente se asocia a la presencia de HTP, pero su especificidad oscila entre el 50-80%[86]. Es un factor predictor de varices esofágicas y se asocia a HTPCS en pacientes compensados.
1.2.2.2. Ascitis
El desarrollo de ascitis constituye la complicación más frecuente de la CH e implica profundos trastornos hemodinámicos y de la función renal relacionados con la HTP[20]. La presencia de ascitis puede facilitar la demostración de una superficie hepática nodular haciendo extremadamente fiable el diagnóstico de CH, si se excluye la existencia de una infiltración metastásica hepática multinodular.
1.2.2.3. Engrosamiento de la pared vesicular
En casos de ascitis de origen no evidente, además de la superficie hepática, se debe valorar la pared vesicular, pues su engrosamiento es muy sugestivo de que la misma sea debida a HTP.
1.3. ESTUDIO DE LA DISFUNCIÓN CIRCULATORIA DE LA HTP
La HTP genera una disfunción circulatoria progresiva que se manifiesta mediante cambios hemodinámicos en la circulación portal, esplácnica y sistémica. Estos cambios pueden ser estudiados mediante ecografía doppler a través de la obtención de información cuantitativa (velocidad y flujo portal) y semicuantitativa [índices de resistencia (IR: V.máx. – V.mín/ V.máx) y pulsatilidad (IP: V.máx. – V.mín/ V.media)], pero su utilidad ha sido poco evaluada en la práctica clínica[21].
1.3.1. Velocidad y flujo portal
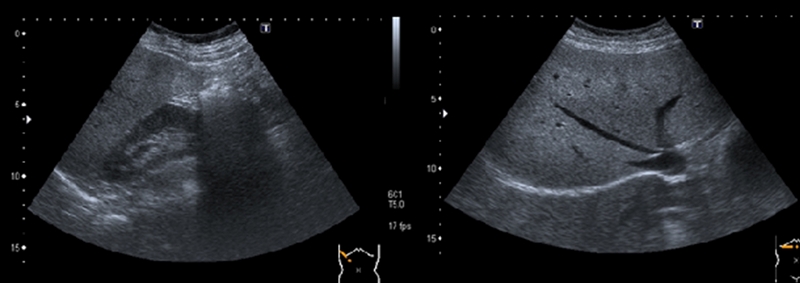
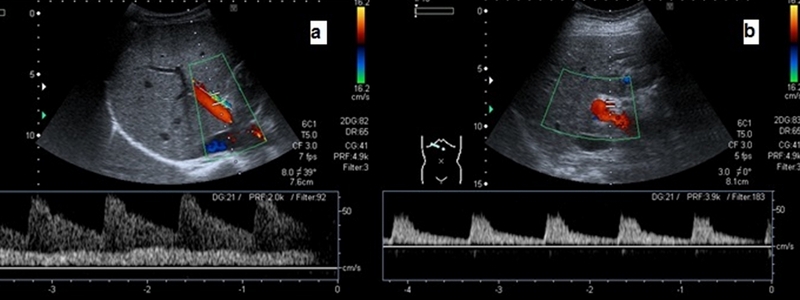
En general, la velocidad portal (Vp) se encuentra disminuida en los pacientes con HTP, habiéndose encontrado en algunos estudios una correlación significativa entre la tendencia a la disminución de la Vp y el incremento del estadio Child-Pugh[22], [23]. Sin embargo, la aportación de este parámetro al diagnóstico de HTP es poco precisa debido a la heterogeneidad del síndrome de HTP, la dependencia del operador y la variabilidad entre equipos de diferentes casas comerciales. Una vena paraumbilical permeable de suficiente calibre aumenta la Vp, mientras que colaterales esplenorrenales pueden disminuir e incluso invertir el flujo portal. Para limitar la variabilidad del operador el resultado debe ser la media de al menos 3 determinaciones de la Vp en la vena porta extrahepática, realizadas en ayunas, en decúbito supino, con una adecuada visualización de la misma, a distancia de la confluencia esplenomesentérica, tomadas con un ángulo de insonación entre 30º y 60º y un volumen muestra de 2/3 del diámetro del vaso[24]. Todos estos factores hacen que la Vp sea difícil de reproducir y que disminuya su aplicabilidad en la práctica clínica; no obstante, hay consenso para considerar patológicas y altamente sugestivas de HTP a valores de Vp < 12 cm/seg[25], [26] (Figura 6).
Figura 6
Tronco portal a) en paciente sin hepatopatía b) porta de flujo lento (<10 cm/seg) en paciente con hepatopatía avanzada.
La cuantificación del volumen de flujo portal se puede calcular conociendo la Vp y el área de la porta en un corte transversal (Q = Vm × A; Q= Volumen de flujo portal, V= velocidad media portal, A= área del círculo portal en un corte transversal). La variabilidad en el caso del flujo portal es superior a la Vp, ya q se suma la posibilidad de errores en el cálculo del área portal.
En un intento de solucionar los problemas de reproducibilidad de la Vp y el flujo, Moriyasu describió el "índice de congestión portal" (IC) que relaciona los dos parámetros que más se alteran en la HTP: el calibre portal que tiende a aumentar y la velocidad de flujo portal que tiende a disminuir. Este índice se calcula dividiendo el área de la porta en un corte transversal por la Vp. Se encuentra elevado en pacientes con CH e HTP, de manera que un IC > 0,12 cm/seg tiene una sensibilidad del 67%[27], si bien este parámetro sólo se ha analizado en pacientes con HTPCS.
1.3.2. Valoración de la circulación arterial esplácnica
La resistencia intrahepática al flujo portal y la vasodilatación esplácnica generan un incremento de la impedancia en las arterias hepáticas y esplénicas[28], [29] y una disminución de la resistencia en las esplácnicas[30], respectivamente.
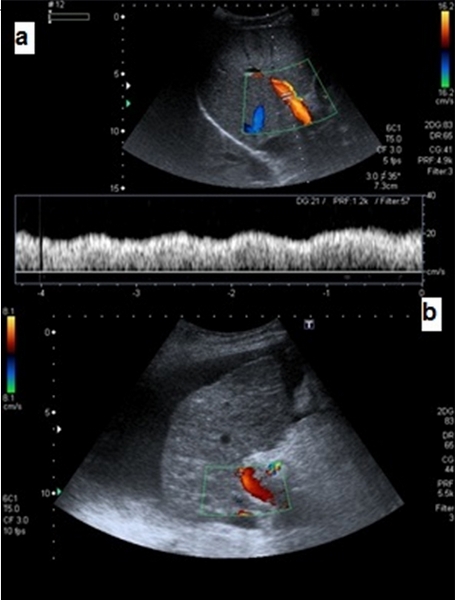
El parámetro que mejor refleja la elevación de la impedancia en la arteria hepática es el IR, el cual muestra correlación positiva con el GPVP y el tamaño de las varices esofágicas, y negativa con la Vp. Es decir, el agravamiento progresivo de la HTP se acompaña de un incremento de la impedancia en la arteria hepática y de una disminución de la Vp[31] (Figura 7).
Figura 7
Dúplex (color y pulsado) de la arteria hepática derecha a) Espectro conjunto de la vena porta y la arteria hepática derecha en paciente sin hepatopatía b) paciente con cirrosis hepática e HTP (IR:0,76).
El "índice vascular hepático" relaciona la Vp (que está disminuida) con las resistencias arteriales hepáticas (que están aumentadas) a través del IV (IV=Vm x 0’57/IP, donde IV es el índice vascular, Vm es la velocidad media de las máximas portales e IP es el índice de pulsatilidad). Cuando su valor es inferior a 12 cm/seg, puede establecerse el diagnóstico de CH e HTP con una sensibilidad del 93% y una especificidad del 97%[32].
La CH también incrementa los IR-IP en las ramas intraparenquimatosas de la arteria esplénica, independientemente del tamaño esplénico, aumento que se correlaciona con la resistencia vascular esplenoportal[33].
A diferencia de las arterias intrahepáticas e intraesplénicas, los IR e IP están disminuidos en la arteria mesentérica superior (AMS) como consecuencia del aumento de la presión sinusoidal y del establecimiento de una circulación esplácnica hiperdinámica. El mejor parámetro para estudiar la resistencia al flujo en esta arteria es el IP, ya que el ayuno en sujetos normales ocasiona una elevada impedancia distal. La disminución del IP en la AMS se ha asociado al empeoramiento de la función hepática y al tamaño de las varices esofágicas[34], [35].
En los pacientes con CH, la activación de los sistemas vasoactivos endógenos provoca una vasoconstricción arterial renal progresiva que puede estudiarse de forma no invasiva a través del cálculo del IR en las arteriolas renales arcuatas o interlobares. La elevación del IR en estas arteriolas renales en pacientes con CH, HTP y ascitis, precede a la elevación de la creatinina, predice la respuesta a tratamiento diurético así como el riesgo de desarrollo de un síndrome hepatorrenal, se asocia con el GPVH y con mayor morbilidad postrasplante[36]-[40].
1.3.3. Valoración de la respuesta al tratamiento de la HTP
En los últimos años se han publicado numerosos trabajos que han analizado los cambios hemodinámicos como resultado del tratamiento farmacológico de la HTP, pero los datos aportados son limitados y en ocasiones carentes de reproducibilidad.
En general, el tratamiento crónico con betabloqueantes no cardioselectivos reduce el flujo portal e incrementa la impedancia esplácnica[41]-[45]. Sin embargo estos datos no nos permiten realizar un control de la eficacia del tratamiento.
Se considera que la profilaxis primaria de la hemorragia digestiva alta secundaria a HTP es eficaz cuando el tratamiento con betabloqueantes no cardioselectivos ocasiona un descenso del GPVH por debajo de 12 mmHg y/o mayor del 20% del valor basal, alcanzándose en no más del 30% de las ocasiones[46]. Berzigotti y col. han constatado que los pacientes no respondedores a nadolol presentan una vasodilatación esplácnica basal significativamente mayor que los respondedores; una velocidad media de la arteria hepática basal superior a 36 cm/seg predice una mala respuesta con una precisión diagnóstica del 86%. Es decir, mediante doppler podríamos seleccionar a un grupo de pacientes con un grado severo de HTP y reducida probabilidad de respuesta a beta bloqueantes.
La administración de drogas vasoactivas mejoraría la distensibilidad de las VSH al modificar el componente hemodinámico atribuido a la HTP[47], [48]. Por tanto, el patrón espectral de la onda de flujo de las VSH podría considerarse como un método no invasivo útil para valorar la respuesta a drogas vasoactivas, pero se precisan más estudios que lo confirmen.
Tampoco se ha podido establecer la utilidad del estudio doppler en la evaluación de la respuesta al tratamiento médico combinado como prevención de la recidiva hemorrágica, ya que aunque se pueda probar con ecografía una mayor reducción del flujo portal, es imposible demostrar la disminución de las resistencias intrahepáticas, hecho en el que se basa el tratamiento farmacológico combinado[49], [50].
1.4. Utilidad de la ecografía convencional en la práctica clínica
El diagnóstico ecográfico de una CH descompensada es relativamente fácil de realizar, al contar con una amplia y bien definida semiología ecográfica que incluye alteraciones de la morfología hepática y signos de HTP (Tabla 1). Estos signos ecográficos de CH e HTP son altamente específicos y pueden ser considerados suficientes para confirmar el diagnóstico, pero un resultado negativo no puede descartar CH. El GPVH se correlaciona con algunos parámetros, como la Vp o el IR de las arterias hepática, esplénica y renal, pero la correlación no es fuerte y por tanto no pueden usarse como marcadores indirectos del GPVH[51].
Tabla 1
Signos ecográficos de cirrosis hepática e HTP.
Ha habido diversos intentos en la literatura por buscar combinaciones de varios de los parámetros ecográficos mencionados para mejorar la eficacia de la ultrasonografía en el diagnóstico de la CH, incluyendo signos de HTP, pero a día de hoy no existe acuerdo. En la mesa Interactiva de Consenso de la Asociación Española de Ecografía de 2001 se propuso que se deberían exigir dos de los tres signos directos para emitir el diagnóstico ecográfico "sugestivo de cirrosis", reservando el término de "patrón de CH" para cuando estén presentes los tres signos directos y/o además coexistan signos inequívocos de HTP[52].
Por el contrario, en pacientes con HC silente las alteraciones de la ecoestructura hepática suelen ser poco expresivas y los signos de HTP pueden estar ausentes. Esta es la razón por la que hasta un 25% de los pacientes que se someten a una biopsia hepática presentan una CH hasta ese momento no sospechada. Tan sólo tres estudios han abordado de forma prospectiva la utilidad de la ecografía en el diagnostico de la cirrosis silente[53]-[55]. La escala de Cádiz establece el diagnóstico de CH silente con una precisión del 92%, mediante un modelo constituido por la valoración de la ecoestructura hepática, el calibre portal y el área esplénica (Tabla 2). Por su parte, la escala de Bolonia obtiene una precisión diagnóstica del 86%, al combinar la disminución de la velocidad de flujo portal y la irregularidad de la superficie hepática (Tabla 3). Macías y col. han demostrado recientemente la utilidad y aplicabilidad de estos dos modelos, cuya combinación no mejora la precisión diagnóstica pero eleva la especificidad al 97%[56].
Tabla 2
Modelo de Cádiz.
| variable | puntuación | ||
| 0 | 1 | 2 | |
| Ecogenicidad hepática | homogénea | granular | nodular |
| Diámetro de la vena porta | <12 mm | =12 mm | |
| Área esplénica | <50 cm2 | =50 cm2 | |
Tabla 3
Modelo de Cádiz.
| variable | puntuación | ||
| 0 | 1 | 2 | |
| superficie hepática | normal | ondulada | nodular |
| Velocidad de flujo portal (cm/seg) | >15 | 15-12 | <12 |
1.5. Signos ecográficos predictores de muerte
Se han descrito cinco signos ecográficos que predicen el riesgo de muerte durante el seguimiento de la HC[57]: a) atrofia hepática[58]; b) aplanamiento de las VSH[59]; c) Vp < 10 cm/seg.[60]; d) elevación del IR en las arteriolas interlobares del riñón[61] ; e) diámetro esplénico bipolar por encima de los 14,5 cm[62] .
ELASTOGRAFÍA HEPÁTICA
2.1. Elastografía transitoria (ET) (FibroScan®, Echosens, París, Francia)
Se basa en la utilización de ultrasonidos (5 MHZ) y ondas elásticas de baja frecuencia (50 Hz) y amplitud cuya velocidad de propagación se relaciona directamente con la elasticidad tisular[63]: a mayor velocidad de propagación, menor elasticidad del tejido. FibroScan® mide un cilindro hepático de 1cm. de diámetro por 2 cm. de longitud (lo que supone una muestra de estudio 100 veces mayor que la obtenida mediante biopsia), es fácil de aplicar, reproducible y cómodo para el paciente. Sin embargo, tiene limitaciones: a) en pacientes obesos el tejido adiposo atenúa de forma marcada tanto la onda de rozamiento como los ultrasonidos, b) es una exploración operador-dependiente, y c) la velocidad detectada no es uniforme en todo el parénquima y puede poner de manifiesto una heterogeneidad en la distribución de la fibrosis o un defecto del procedimiento.
La ET se ha mostrado útil en el diagnóstico de CH de cualquier etiología y sus complicaciones, ya que la rigidez hepática se correlaciona con el estadio de fibrosis y con el grado de presión portal, respectivamente. Sin embargo, los valores óptimos para clasificar la severidad de la enfermedad pueden variar según la etiología de la enfermedad. Los dos estudios clásicos realizados en pacientes con hepatitis crónica C – Ziol y col. y Castera y col.- han demostrado una excelente fiabilidad para identificar CH con un valor óptimo de rigidez hepática muy similar en ambos: 14.5 kPa (VPN: 97%) y 12.5 kPa (VPN: 95%), respectivamente[64], [65]. Sin embargo, los valores útiles para estimar F4 en una HC de cualquier causa no están claramente establecidos. Foucher y col. estudiaron a 711 pacientes con HC de diversas etiologías y encontraron que un valor de corte de 17,6 KPa podía detectar el 90% de los pacientes con CH[66]. Por su parte, Ganne-Carrie y col. identificaron una tasa similar de pacientes con CH con un valor ≥ 14.6 kPa[67]. Se ha descrito una excelente correlación entre la rigidez hepática (kPa) medida con ET y el GPVH. Sin embargo, la técnica no es lo suficiente precisa como para evaluar la severidad de la HTP. Vizzutti y cols. demostraron una buena correlación entre la ET y el GPVH (r= 0.81) en pacientes con fibrosis avanzada (F3-F4). El 97% de los pacientes con HTPCS (GPVH ≥ 10 mm Hg) presentaban un valor de ET > 13,6 kPa. La correlación entre el ET y el GPVH fue excelente para pacientes con GPVH < 10 mm Hg (r= 0.81), peor en pacientes con valores superiores (GPVH > 10 mm Hg) (r= 59), pobre para identificar la presencia de varices esofágicas y ausente para determinar su tamaño[68].
2.2. Elasticidad hepática en tiempo real
La elasticidad hepática en tiempo real es una nueva técnica para estimar la fibrosis que tiene la ventaja de que va integrada a un ecógrafo convencional. En la actualidad contamos con dos sistemas: a) radiación acústica de la fuerza de impulso de imagen (ARFI) integrada a un ecógrafo Acuson 2000®, Virtual Touch Quantification mode, Siemens Medical Solutions, Mountain View, Ca, EE. UU.) b) La elasticidad en tiempo real (HI-RTE) acoplada al ecógrafo Hitachi EUB-8500 y EUB-900. Los datos publicados por Colombo y col. atribuyen mayor precisión a la ET que a estos dos sistemas de elastografía en tiempo real en el diagnóstico de fibrosis hepática, si bien se necesitan más estudios[69].
ECOGRAFÍA CONTRASTADA
Mediante la administración de contrastes ecográficos de segunda generación (Sonovue®) podemos calcular el tiempo de la circulación intrahepática y estimar la perfusión hepática regional.
El tiempo de tránsito a la vena hepática es una técnica muy sensible para predecir la severidad de la HC y podría ser un complemento a la ecografía convencional y doppler en el seguimiento de la enfermedad. Se ha observado que a medida que la enfermedad avanza el tiempo de tránsito disminuye, debido a los shunts arterio-venosos y a la arterialización de los lechos capilares del hígado.
Staub y col. han demostrado que el tiempo de tránsito venoso portohepático se correlaciona con la fibrosis de manera inversa en pacientes con HC silente; un valor de corte de 13 seg puede diferenciar la fibrosis severa (F3-4) de una leve (F1-2) con una precisión cercana al 80%[70].
Por otra parte, Zhang y col. encuentran que el tiempo de circulación intrahepática se correlaciona con la severidad de la HTP; de forma que el tiempo de llenado de las VSH y el tránsito arteriohepático disminuye, mientras que el tiempo de llenado portal y el tránsito arterioportal aumenta, en pacientes con HTP[71].
En la CH se produce una alteración mecánica de la microcirculación como consecuencia del desarrollo de fibrosis y nódulos de regeneración. Se ha demostrado mediante ecografía contrastada que la perfusión hepática portal está incrementada en pacientes cirróticos y que esta alteración de la microcirculación se correlaciona con parámetros de función hepática (Child, MELD), reserva funcional e HTP (calibre y flujo portal)[72].
En conclusión, es probable que en el futuro próximo los avances en las técnicas de imagen ecográfica sean capaces de acercarnos al concepto de CH e HTP interpretada por la biopsia hepática y el GPVH. A día de hoy, parece razonable evaluar la utilidad conjunta de los métodos no invasivos en el diagnóstico de CH y sus complicaciones: marcadores bioquímicos, ecografía convencional, elastografía y contrastes. No obstante, hay que seguir investigando ya que todos ellos requieren una mayor exactitud en la predicción.