CORRESPONDENCIA
Aida Selfa Muñoz
Servicio de Aparato Digestivo. Hospital San Cecilio.
Avda Dr Olóriz, Nº16, 18012. Granada. España.
Teléfono: 958023325
aidasale@hotmail.com
Introducción
El cáncer de páncreas es la quinta causa de muerte relacionada con el cáncer en los Estados Unidos. En España la incidencia se encuentra alrededor de 7/100000 habitantes. La mayoría presentan metástasis en el momento del diagnóstico y la media de supervivencia es de 18-20 meses[1]. La resección quirúrgica es el único tratamiento con fines curativos. El pronóstico de esta neoplasia es muy pobre, la supervivencia actual es menor del 5% a los 3 años. A pesar de los avances en las técnicas diagnósticas, tan solo entre el 7-20% de los pacientes presentan un tumor resecable en el momento del diagnóstico; y aún en este caso, la supervivencia a los 5 años es del 20-40%[2], [3].
El diagnóstico del cáncer de páncreas se realiza mediante diferentes técnicas de imagen: ecografía, tomografía axial computerizada (TC), colangiopancreatografía retrógrada endoscópica (CPRE) y más recientemente TC helicoidal, resonancia magnética y ecoendoscopia (USE). Sin embargo la sensibilidad y especificidad de estas pruebas diagnósticas es muy heterogénea. La USE es actualmente la técnica diagnóstica con mayor sensibilidad y especificidad en el diagnóstico del cáncer de páncreas[4]; en manos de un endoscopista experimentado se han descrito una sensibilidad y especificidad del 99 y 100% respectivamente[5]; siendo especialmente útil en la detección de lesiones menores de 3 cm[6], [7], determina con mayor fiabilidad la invasión local de estructuras vecinas, la afectación de adenopatías regionales y el compromiso de estructuras vasculares vecinas (en concreto la invasión de tronco celiaco, porta, arteria y vena mesentérica superior y hepática común). Además permite la realización de punción aspiración con aguja fina (PAAF) para obtener la confirmación histológica[8].
Caso clínico
Mujer de 73 años con antecedentes de hipertensión arterial e hiperreactividad bronquial. Acudió a urgencias por presentar epigastralgia de unos 3-4 meses de evolución, irradiada hacia ambos hipocondrios y espalda, sin relación con la ingesta y que se había intensificado en los últimos días. El cuadro se acompañaba de astenia y anorexia con pérdida ponderal no cuantificada, así como de hábito intestinal estreñido. La paciente no refería vómitos, fiebre ni otra sintomatología asociada. A la exploración abdominal destacaba masa de consistencia dura y bordes irregulares que ocupaba epigastrio e hipocondrio derecho, dolorosa a la palpación.
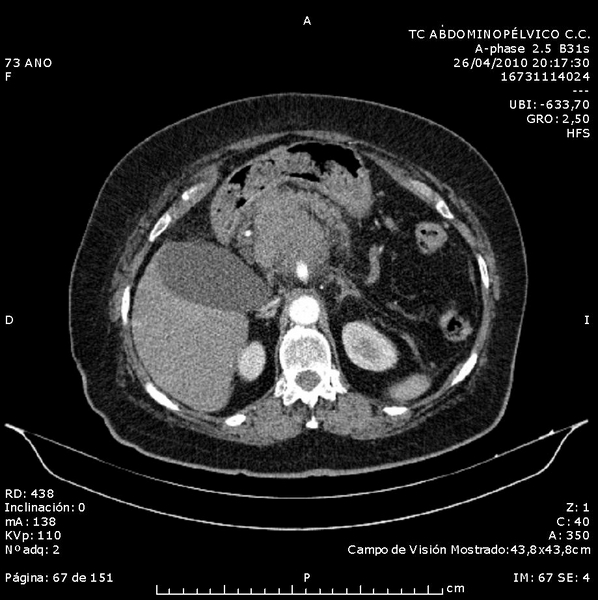
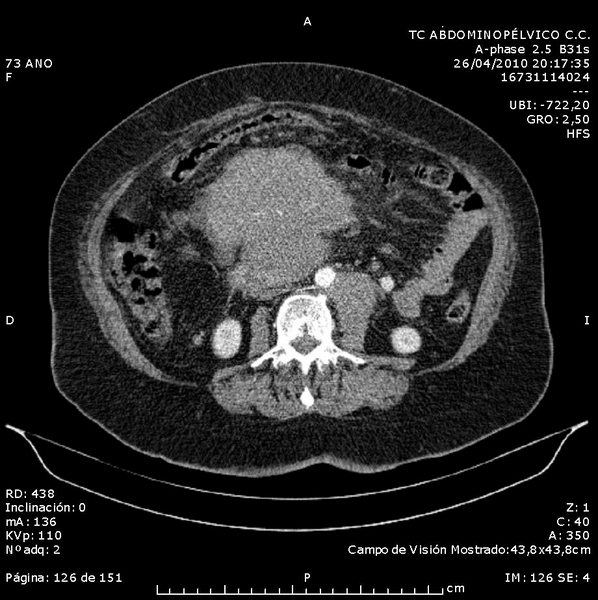
Se realizó analítica urgente en la que destacaba GOT 51 U/L [normal<40], GPT 44 U/L [normal<40], LDH 496 U/L [normal 230-400], PCR 1.9 mg/dl [normal 0-0.5], resto de hemograma, bioquímica y coagulación sin hallazgos; TC abdominopélvico con contraste IV que informó de: "masa hipercaptante heterogénea y polilobulada de 20x10x11 cm (CC, AP y axial) en cabeza y cuerpo pancreáticos con prolongación prerrenal derecha, que engloba e infiltra eje esplenoportomesentérico, con defecto de replección en porta derecha próxima bifurcación portal; conglomerado adenopático paraórtico izquierdo de 40x45 mm. Juicio diagnóstico: carcinoma de páncreas estadio T4N1" (Figuras 1 y 2). Se le ingresó a cargo de digestivo para completar el estudio.
Figura 1
TC abdominopélvico que muestra una masa hipercaptante heterogénea y polilobulada en cabeza y cuerpo pancreáticos.
Figura 2
Prolongación prerrenal derecha que engloba e infiltra eje esplenoportomesentérico, con defecto de replección en porta derecha próxima a bifurcación portal.
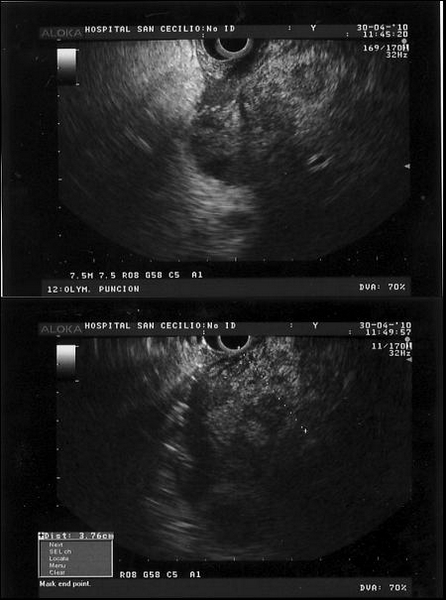
Durante el ingreso se solicitaron los marcadores tumorales: CA19.9 85.2 UI/ml [normal 0-37], CA125 202 UI/ml [normal 0-45], resto (AFP, CA15.5 y CEA) dentro de la normalidad. Dados los hallazgos se solicitó USE para la realización de PAAF, la USE confirmó los hallazgos del TC abdominal, apreciándose la existencia de una masa de ecogenicidad heterogénea e irregular, de gran tamaño (>15 cm), que ocupa parte de la cabeza y cuerpo pancreáticos, procediendo a realizar PAAF en presencia del anatomopatólogo (tres pases) obteniéndose material suficiente para su estudio. Además se objetivó la existencia de afectación de la vena porta, de adenopatías a nivel del eje esplenomesentérico, y líquido ascítico perihepático. Vesícula distendida (Courvasier) (Figura 3).
Figura 3
Gran masa (>15 cm) de ecogenicidad heterogénea e irregular que ocupa parte de cabeza y cuerpo pancreáticos.
En el informe de anatomía patológica: "se observan células de la mucosa intestinal y numerosas células linfoides de mediana-gran talla, redondeadas que son CD10-; CD20+; BCL2 +. Diagnóstico: compatible con linfoma B de células grandes". Se presentó el caso a Oncología, y dados los resultados, se realizó biopsia de médula ósea (cresta iliaca) que informaba de la ausencia de infiltración por linfoma, pautándole tratamiento quimioterápico con Rituximab-CHOP (ciclofosfamida, adriamicina, vincristina y prednisona).
La paciente recibió 5 ciclos de quimioterapia y antes del último desarrolló una neutropenia febril sin foco, como consecuencia de ésta se deterioró y sufrió un tromboembolismo pulmonar agudo asociado a una perforación espontánea de sigma, fue sometida a una hemicolectomía izquierda (Hartmann) falleciendo a los pocos días.
Discusión
El linfoma pancreático primario es raro, supone el 0.2-4.9% de los tumores malignos de páncreas y menos del 1% de los linfomas no-Hodgkin (LNH)[9]. El LNH se localiza con frecuencia en sitios extraganglionares, sobre todo en el tracto gastrointestinal y rara vez en páncreas. En este caso se cumplen los criterios para la definición de los linfomas primarios del páncreas de Behrns et al[10]: masa predominantemente dentro del páncreas con afectación de los ganglios linfáticos limitado a la región peripancreática, sin adenopatías superficiales o del mediastino, sin afectación hepática o esplénica y recuento normal de leucocitos.
Las manifestaciones clínicas del linfoma pancreático incluyen dolor abdominal (75%), masa abdominal palpable (54%), pérdida de peso (50%), ictericia (40%), sudoración nocturna (22%) y fiebre (20%)9.
En el diagnóstico del cáncer de páncreas, la USE es el examen no invasivo más sensible para el diagnóstico de afectación vascular. Un metanálisis, en el que la invasión vascular se confirmó por cirugía o angiografía, demostró que la USE tiene una alta especificidad (90%) y moderada sensibilidad (73%) para detectarla[11].
Se puede concluir a partir de los datos referidos y de la experiencia clínica, que la USE y la TC son estudios complementarios para la estadificación del cáncer de páncreas. USE es una modalidad más precisa para el estadiaje (T) y para valorar la invasión vascular, especialmente en tumores menores de 3 cm, en los que ha demostrado ser mejor opción en comparación con la TC[12]. Para la evaluación de las metástasis a distancia (M) es de elección la TC[13], siendo ambas técnicas equivalentes en la estadificación ganglionar (N)[14].
Como demuestra el caso que hemos presentado, es fundamental establecer un diagnóstico histológico antes de decidir la actitud ante una masa pancreática (terapeútica vs paliativa), ya que existen neoplasias malignas relacionadas con el páncreas (como linfomas, carcinomas de células pequeñas, enfermedad metastásica y tumores neuroendocrinos gastrointestinales), así como procesos no malignos (como la pancreatitis crónica autoinmune) capaces de simular un adenocarcinoma y entre cuyo tratamiento puede estar incluida o no la resección quirúrgica[15].
La controversia surge sobre cuál es el mejor método para obtener tejido diagnóstico en pacientes con sospecha de cáncer de páncreas: si PAAF guiada por TC (TC-PAAF) o USE-PAAF[16]. Se ha demostrado un aumento del riesgo de diseminación peritoneal en sujetos sometidos a TC-PAAF en comparación con la USE-PAAF[17]. Horwhat et al[18] publicaron un estudio prospectivo y aleatorizado sobre la sensibilidad y precisión de la USE-PAAF en comparación con la PAAF guiada por TC o ecografía (TC/US-PAAF) en 84 pacientes con cáncer de páncreas. Llegaron a la conclusión de que la sensibilidad de la TC/US-PAAF y la USE-PAAF para detectar malignidad son del 62 y 84% respectivamente, aunque la diferencia no fue estadísticamente significativa.
Es importante resaltar la capacidad de la USE para guiar una aguja de biopsia y obtener material en las lesiones que son demasiado pequeñas para ser identificadas por TC o resonancia magnética o con estructuras vasculares circundantes que no permiten la biopsia percutánea[19].
La USE-PAAF tiene una alta sensibilidad (93%) y especificidad (100%) en el diagnóstico de masas pancreáticas[7], aumentando la precisión en el diagnóstico si ésta se realiza en presencia de un anatomopatólogo[6].
Battula et al[20] llevaron a cabo una revisión de los casos de linfoma de páncreas publicados entre 1951 y 2005 (89 casos) y observaron una tasa de respuesta completa del 100% y de supervivencia a largo plazo del 94% con cirugía y quimioterapia adyuvante; frente a una supervivencia a los 5 años menor del 50% con la quimioterapia, radioterapia o una combinación de ambas. Concluyen que la pancreaticoduodenectomía parece tener un papel terapeútico al asociarla a la quimioterapia.
En cambio Grimison et al[21] obtienen, en LNH de medio o alto grado y localizados, tratados con quimioterapia con el régimen CHOP (cicofosfamida, doxorrubicina, vincristina, prednisona) y radioterapia adyuvante, resultados similares a las series publicadas de pacientes sometidos a resección quirúrgica.
Hoy en día la quimioterapia es el tratamiento de elección para la mayoría de los pacientes con linfoma pancreático. La pautas más comunes son: CVP (ciclofosfamida, vincristina y prednisona), CHOP, MACOP-B (metotrexate, adriamicina, ciclofosfamida, vincristina, prednisona, bleomicina)[22]. Por otro lado la adición de rituximab (anticuerpo monoclonal quimérico contra el antígeno CD20 de las células B) a la pauta CHOP, aumenta la tasa de respuesta completa y prolonga en general la supervivencia de estos pacientes, sin un aumento clínicamente significativo de la toxicidad[23].