CORRESPONDENCIA
Adolfo Parra Blanco
Unidad de Endoscopia.
Hospital Universitario Central de Asturias.
parrablanco@gmail.com
Introducción
El aumento en la incidencia del adenocarcinoma esofágico, y su relación con el Esófago de Barrett (EB), condición en la que se somete a los pacientes a una vigilancia endoscópica e histológica, y el desarrollo de investigación en esta área, ha llevado a que se detecte un número creciente de lesiones displásicas inaparentes, y de lesiones neoplásicas precoces aparentes, ambas subsidiarias de tratamiento endoscópico. El desarrollo tecnológico permite disponer de diferentes herramientas para llevar a cabo estos tratamientos[1,2]. Se revisan las alternativas disponibles, y el estado actual del tema. No se entrará a valorar la necesidad y conveniencia de realizar estudios endoscópicos repetidos con toma de múltiples biopsias en los pacientes con EB, siendo este un tema de controversia permanente, y probablemente creciente[3,4]. De cualquier forma, se acepta de forma inequívoca por los expertos que los pacientes en que se detecten neoplasias precoces deben ser valorados y tratados en unidades especializadas en esta patología[5]. Y por otra parte, el establecimiento de consultas monográficas en esta área permite un mejor diagnóstico y tratamiento, permitiendo un uso más racional de los recursos endoscópicos[6].
La posibilidad de realizar métodos endoscópicos de tratamiento de la displasia de alto grado, ha sido frecuentemente cuestionada por la existencia de series de esofagectomía en las que en aproximadamente el 40% de pacientes existía cáncer invasivo no sospechado endoscópicamente[7]. Una reciente revisión del tema clarificó que los criterios de neoplasia invasiva en las dichas series no eran uniformes, y en resumen estableció que la tasa de neoplasia invasiva (a submucosa o mayor) es de 13% en pacientes con displasia de alto grado sometidos a esofagectomía[8]. En caso de existir lesiones visibles endoscópicamente, la tasa era de 11%, y en ausencia de dichas lesiones, sólo 3%. Parece claro que el riesgo de neoplasia invasiva se había sobreestimado previamente, y la estimación más realista justifica la aplicación de tratamiento endoscópico en pacientes bien seleccionados.
Técnicas de resección endoscópica
La resección endoscópica ha sido la base del tratamiento endoscópico de EB, y su uso se ha recomendado no sólo como técnica para eliminar la enfermedad, sino para el estadiaje de las lesiones detectadas. La mayor ventaja de las técnicas de resección es su capacidad de proporcionar muestras de tamaño y profundidad adecuadas para el estudio histopatológico. La resección en bloque permite analizar los márgenes laterales y así determinar la necesidad de tratamiento adicional. La resección endoscópica de neoplasia esofágica precoz fue descrita inicialmente en 1991 por autores japoneses (la mayoría de ellos con neoplasia escamosa), con buenos resultados[9,10].
Al igual que cuando se plantea el tratamiento endoscópico de otras neoplasias precoces en diferentes localizaciones del tubo digestivo, en el EB también deben clasificarse las lesiones según la clasificación de París[11]. Esto resulta fundamental, ya que para establecer la indicación de tratamiento debemos conocer la morfología y el tamaño de las lesiones visibles (en caso de existir). Se acepta que las lesiones con buen o moderado grado de diferenciación, de hasta 2 cm, y con morfología no ulcerada pueden ser subsidiarias de tratamiento endoscópico (o al menos de resección como método de estadiaje)[5]. Aunque en las lesiones de tipo protruido la probabilidad de invasión a submucosa es mayor, no se considera una contraindicación. Lesiones de mayor tamaño representan una indicación relativa, y la decisión terapéutica debe basarse en las características y deseo del paciente, incluyendo comorbilidad y riesgo quirúrgico, y en la experiencia local en el tratamiento endoscópico y quirúrgico.
Un tema de controversia es la necesidad de realizar un estadiaje por ultrasonografía endoscópica (USE) antes de plantar el tratamiento en la neoplasia precoz en EB. Un reciente estudio retrospectivo realizado en 113 pacientes en los que llevó a cabo una resección endoscópica de lesiones visibles, y en los que se había realizado previamente una USE, concluyó que la ecoendoscopia sobreestadía algunos pacientes, e infra estadía a otros, mientras que la resección endoscópica como método de estadiaje (y terapéutico en muchos casos) es más exacta[12]. Así, de aquellos pacientes en que ni la endoscopia ni la USE hacían sospechar lesión invasiva, en 24% había factores de riesgo de afectación ganglionar (invasión a submucosa u otros factores histológicos). Cuando sólo la USE era sospechosa, en 50% de los casos había factores de riesgo, pero en 50% la resección se consideró curativa. E incluso, cuando tanto la endoscopia como la USE hacían sospechar una lesión maligna con invasión y/o afectación ganglionar, en 25% de los casos el estudio de la pieza no mostraba factores de riesgo de afectación ganglionar, por lo que en ellos se evitaba el tratamiento quirúrgico. Por ello los autores recomiendan recurrir a la resección endoscópica como método de estadiaje, siempre que se considere técnicamente posible, e incluso en caso de que existan dudas sobre la resecabilidad curativa de la lesión (evidentemente, si no hay certeza absoluta de invasión o afectación ganglionar).
Mucosectomía
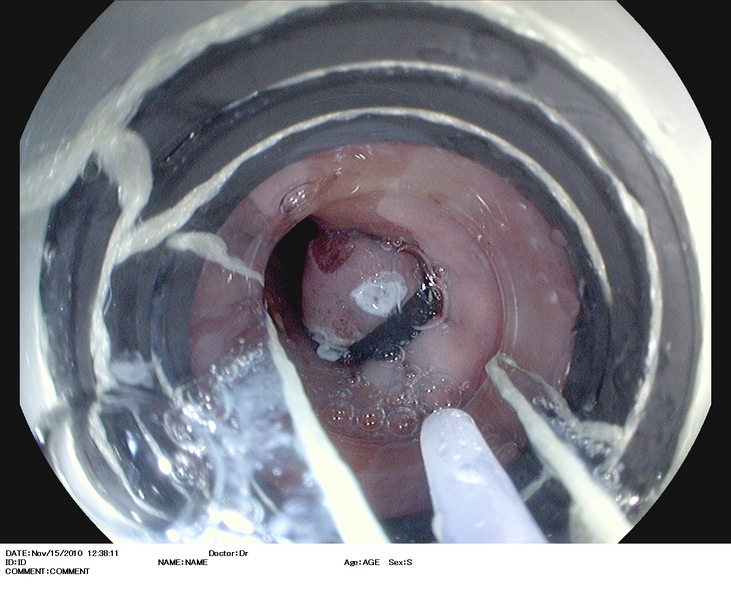
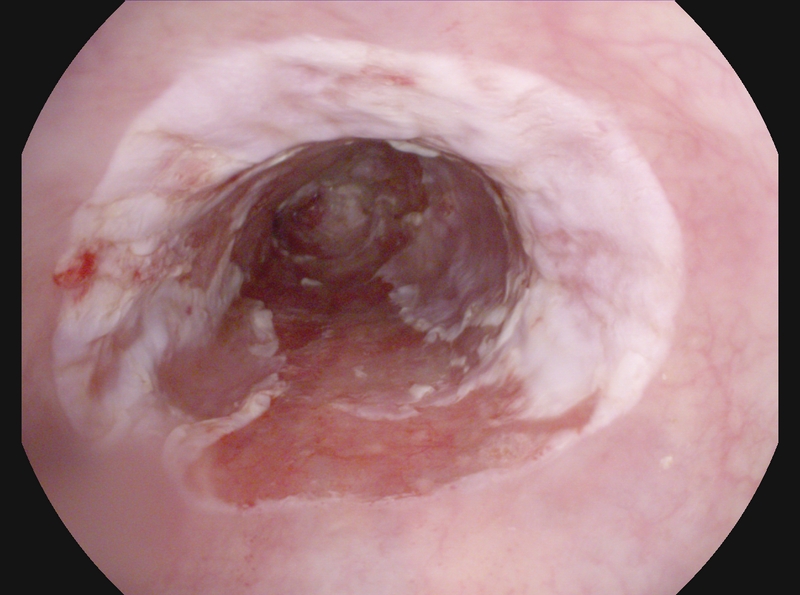
Se han desarrollado diferentes técnicas para la escisión de lesiones mucosas; las más empleadas son la técnica de capucha-aspiración, y la de las multibandas[10,13]. No existen diferencias significativas en eficacia y seguridad entre ambos métodos, salvo que el tamaño del espécimen es algo mayor con la capucha. En un estudio aleatorizado empleando capucha-aspiración, o multibandas, para tratar lesiones visibles, la resección con multibandas resultó en especímenes con un diámetro significativamente menor (18 vs 20 mm), pero el tiempo del procedimiento fue y el coste fueron significativamente menores[14]. Hubo perforación en 2% de casos con multibandas, frente a 7% con capucha. El uso de las multibandas va imponiéndose a la capucha-aspiración, por su facilidad, seguridad, y eficacia (Figuras 1, 2).
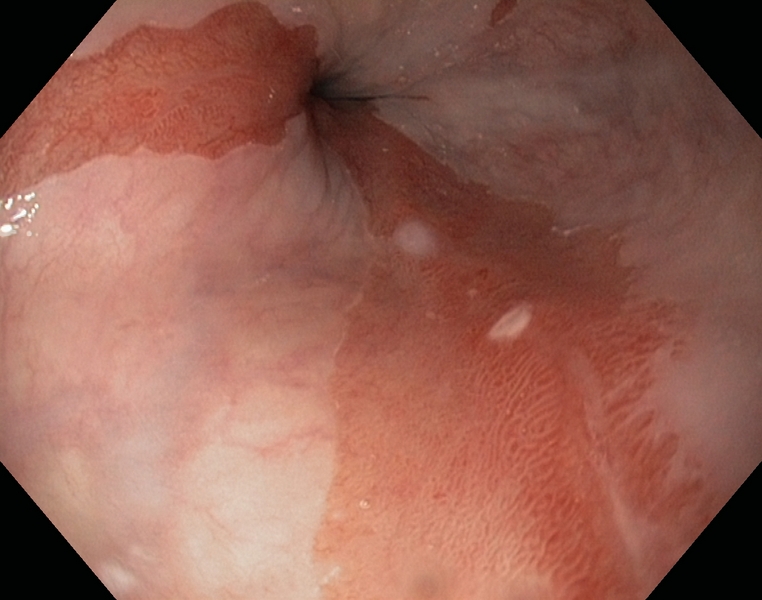
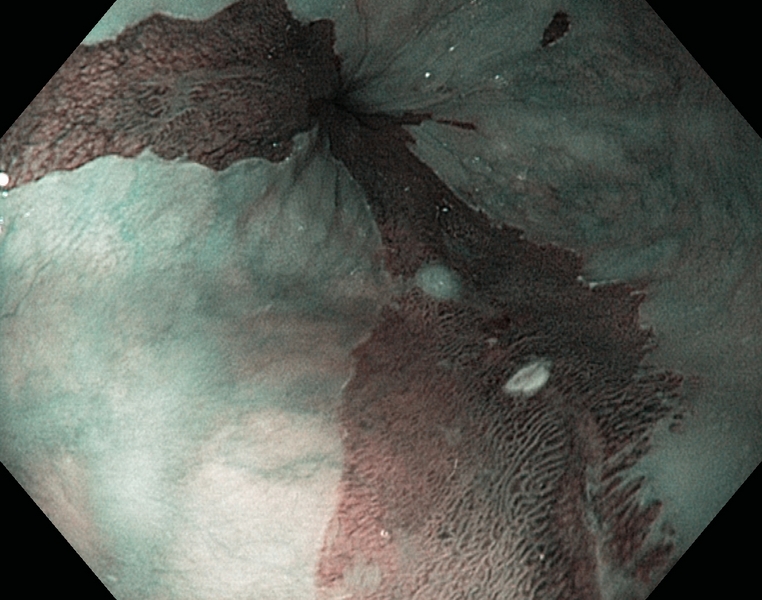
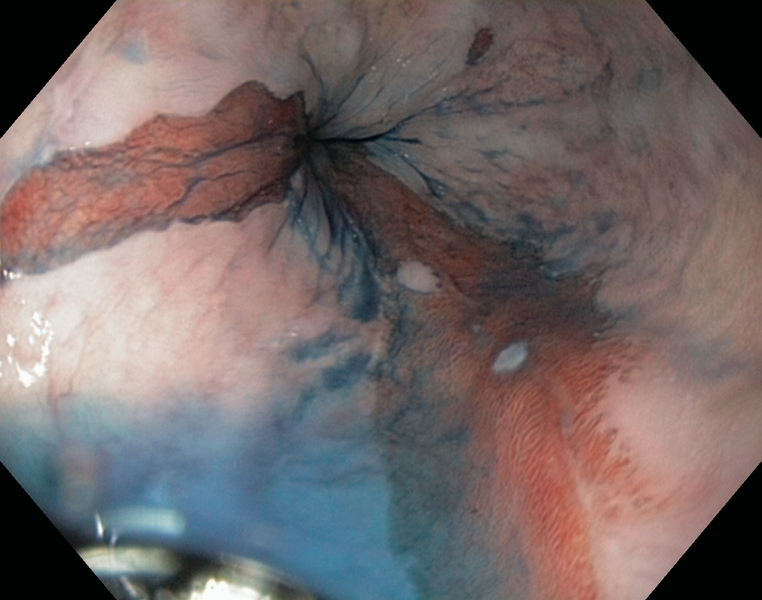
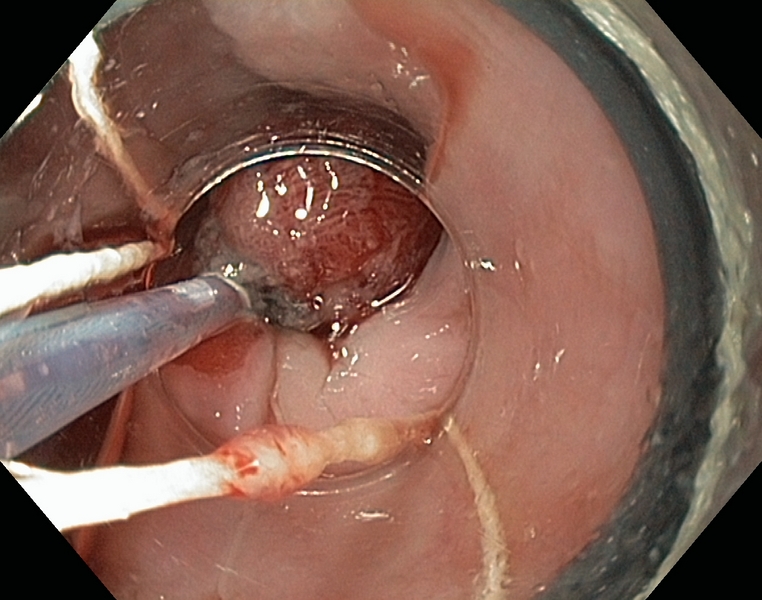
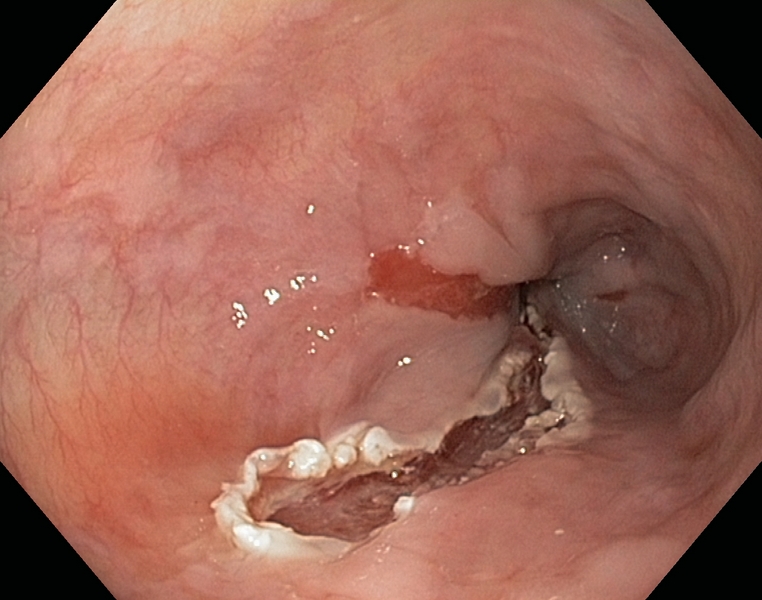
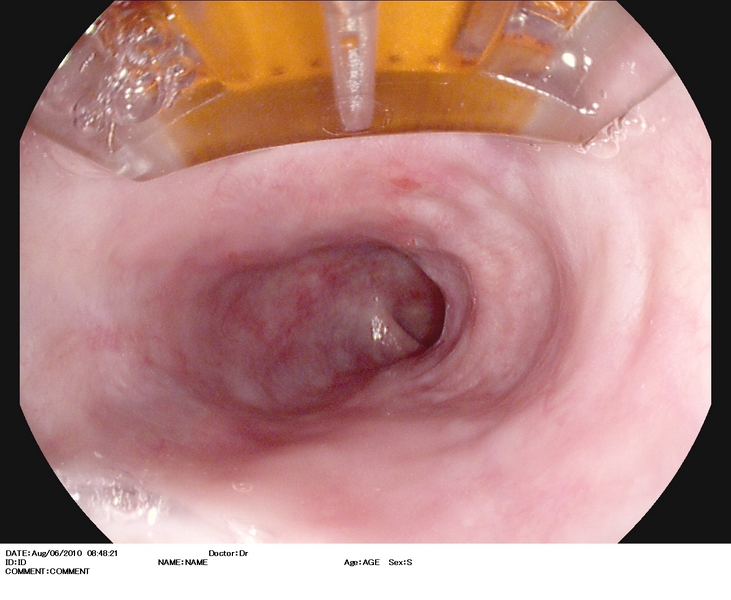
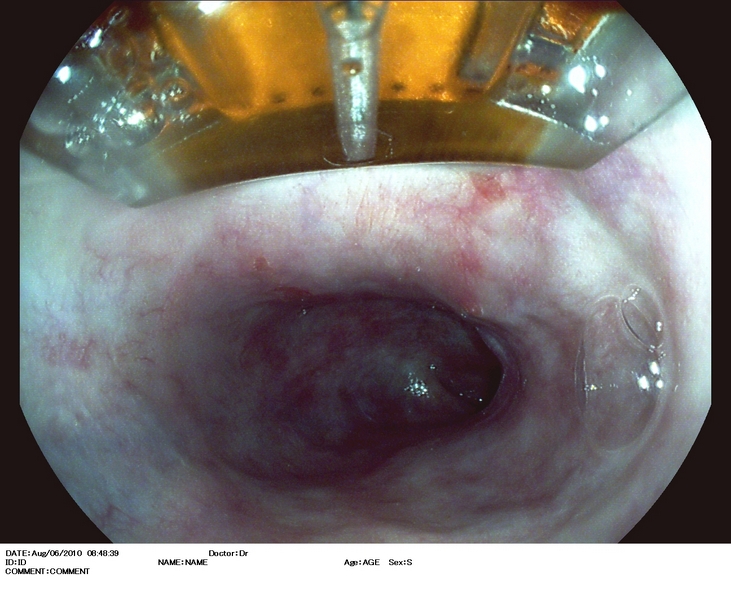
Figura 1
Esófago de Barrett (C1M5) con displasia de alto grado. Se observa una zona deprimida lineal, que se explora con alta definición (1.A), NBI (1.B), e índigo carmín 0.5% (1.C). Se realiza extirpación con multibandas, en dos resecciones (1.D). Aspecto tras la resección (1.E).
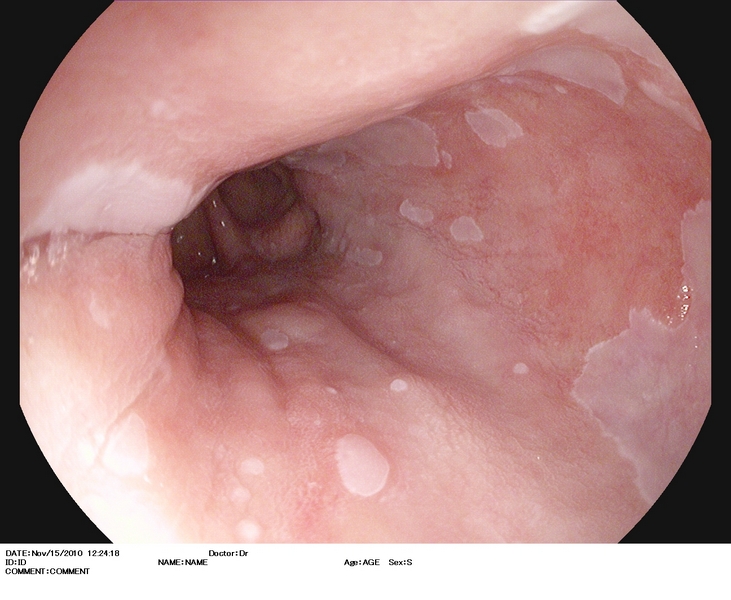
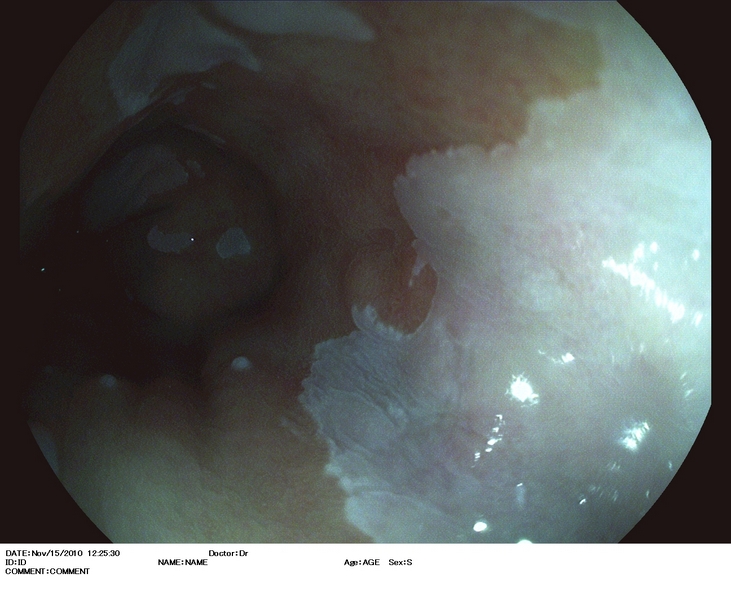
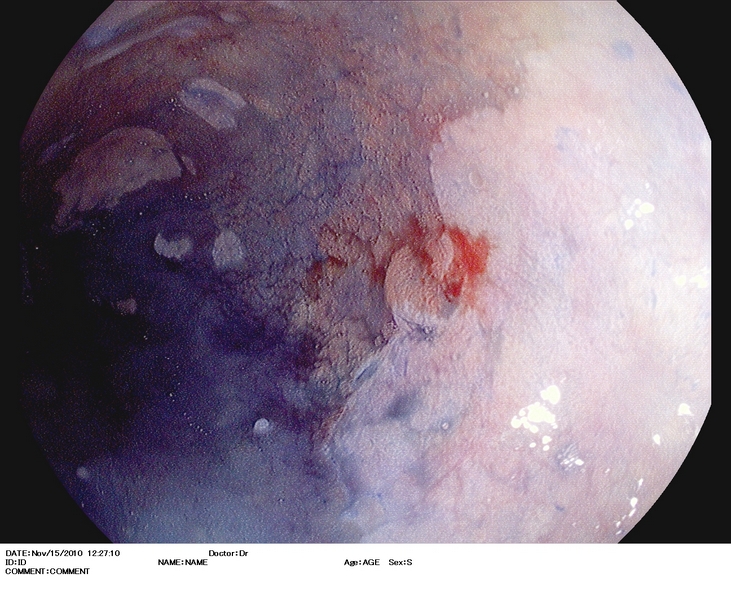
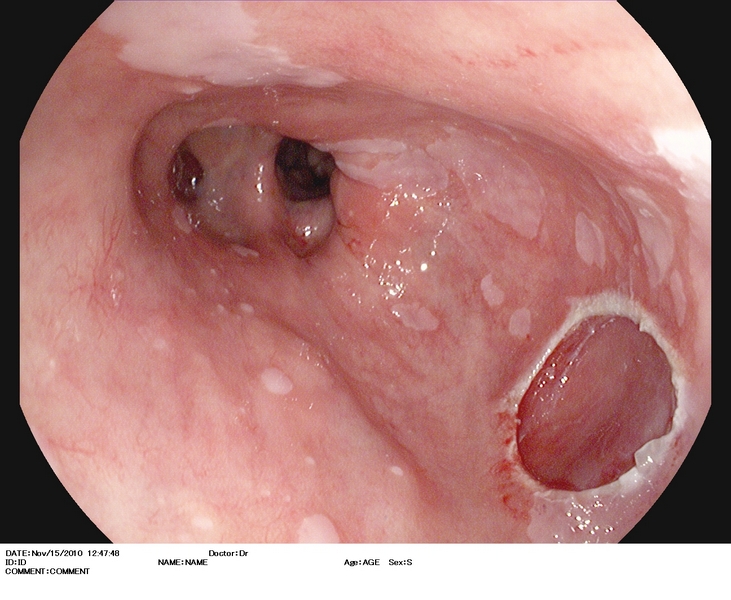
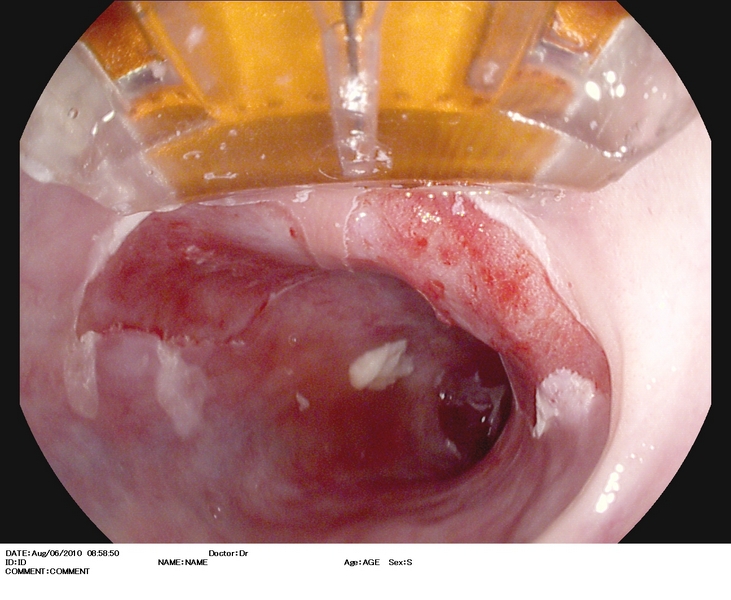
Figura 2
Esófago de Barrett (antecedentes de cirugía antireflujo), con lesión casi inadvertida (2.A) situada en una lengüeta a las 3 h. en el monitor. Se explora con i-Scan (2.B), índigo carmín 0.5% (2.C), y se extirpa con DuetteR (2.D). Imagen tras la resección (2.E). Es estudio anatomopatológico reveló displasia de alto grado. El paciente fue sometido 12 semanas después a tratamiento con radiofrecuencia.
Existe ya una amplia experiencia en la resección focal de lesiones visibles macroscópicamente en el seno de un EB[15], [16]. Se consigue una regresión completa de la neoplasia en 97-100% de los casos. La seguridad empleando multibandas es destacable; en un estudio reciente con más de 1000 resecciones en más de 200 pacientes, no se registró ninguna perforación, con una tasa de sangrado diferido del 2%[13]. La resección endoscópica además ofrece ventajas diagnósticas sobre las muestras de biopsia convencionales. Se ha mostrado una mejor concordancia interobservador en el diagnóstico histológico de displasia (tanto de bajo como de alto grado) cuando se analizan muestras de mucosectomía, que muestras de biopsias convencionales[17]. La exactitud diagnóstica resulta imprescindible para poder diferenciar lesiones T1m de T1sm, ya que en estas últimas debe realizarse un tratamiento quirúrgico adicional.
Por otra parte, las muestras de mucosectomía incluyen submucosa en casi el 90% de especímenes, frente al 1% cuando se trata de muestras de biopsia. Además, los especímenes de mucosectomía permiten evaluar la afectación vascular y linfática.
El principal problema de aplicar la mucosectomía focal como tratamiento único de la neoplasia en el EB es la posible aparición de enfermedad sincrónica y metacrónica en el tejido de EB residual. La incidencia de neoplasia metacrónica en 3 años es de 10-50%[1], [15], [16]. Por dicho motivo se han propuesto la resección endoscópica total del EB, y la radiofrecuenciapara eliminar el tejido residual de EB.
Resección endoscópica completa del EB
La justificación para realizar la resección completa del EB es la demostración de lesiones multifocales de displasia de alto grado, y la elevada tasa de lesiones sincrónicas y metacrónicas cuando se emplea la mucosectomía focal como método único. La mayor ventaja sobre los métodos de ablación sin resección (radiofrecuencia, terapia fotodinámica, crioterapia) es que con la mucosectomía se obtiene material para estudio histológico, lo cual no sucede con las otras técnicas.
Con este método, todo el segmento de EB es erradicado mediante resección en una o más sesiones, permitiendo el tratamiento de las neoplasias ocultas que pueda existir, y previniendo la aparición de lesiones nuevas en el seguimiento.
Se consigue la erradicación del EB en 86% a 100% de los casos, y de cualquier neoplasia en 75-100%[18]-[20]. Cuando se aplica esta técnica, la tasa de recurrencia de neoplasia es 3%, muy inferior a lo descrito por mucosectomía focal del EB. La mayoría de las lesiones recurrentes son de displasia de alto grado, y se localizan distalmente a la neo-línea Z, por lo que es recomendable realizar una inspección detallada de dicha zona.
La mayor limitación de la resección completa del EB es la elevada incidencia de estenosis, que llegan al 88%, y que se relaciona con la longitud del EB resecado[21]. La dilatación profiláctica realizada semanalmente tras la resección parece reducir la incidencia de estenosis.
Un estudio retrospectivo observó que la mucosectomía completa permite evidenciar casos con neoplasia invasiva (o al menos con factores histológicos de riesgo para la existencia de afectación ganglionar) en 13% de los casos tratados por displasia de alto grado o neoplasia precoz[19].
Se considera que la resección total del EB es una técnica excelente en casos de displasia EB con longitud ≤5cm. La mayor ventaja de la resección completa del EB es la posibilidad de disponer de muestra de todo el tejido, y las desventajas son la mayor complejidad técnica que la radiofrecuencia, y la elevada tasa de estenosis.
Disección Endoscópica Submucosa (DES)
La DES representa en Japón la técnica de elección para el tratamiento de neoplasias gástricas intramucosas, y cuando se realiza por expertos los resultados para lesiones esofágicas y colónicas parecen superiores a la mucosectomía convencional en términos de tasas de resección curativa y recurrencia[22], [23]. Los mayores inconvenientes son el elevado riesgo de perforación, y la larga duración de los procedimientos, ambos derivados de la elevada complejidad técnica.
Existen pocos datos aún sobre los resultados de la DES en adenocarcinomas esofágicos, ya que en Japón éstos son raros en comparación con la neoplasia escamosa. Se ha comunicado en tres series japonesas una tasa del 96-100% de remisión completa de la neoplasia, y del 70-79% de resección curativa en adenocarcinomas localizados en la unión esófago-gástrica[24]-[26]. Ocurrieron estenosis en 3-8%, y perforaciones en 0-3%. Comparada con la mucosectomía, la DES muestra una mejor tasa de resección en bloque, con márgenes negativos, lo que lleva a tasas de recurrencia muy inferiores. Se han comunicado en forma de resumen dos trabajos occidentales (Bélgica y EEUU) sobre tratamiento de neoplasias en EB mediante DES[27], [28]. Los resultados son prometedores considerando eficacia y seguridad: remisión completa de neoplasia en 89-100%, eliminación de la metaplasia intestinal en 84%, y perforación en 0-8%. No obstante como se ha explicado, la mucosectomía (generalmente en múltiples fragmentos) ha demostrado unos excelentes resultados a largo plazo. Considerando que es una técnica mucho más fácil de aplicar, y asociada a menos riesgo de complicaciones, no parece fácil que la DES llegue a implantarse como método de elección, y los expertos en esta área critican por dicho motivo el empleo de DES[29]. De cualquier modo, la aplicación de DES en humanos debería ser precedida por un entrenamiento adecuado, que debe incluir la visita a centros expertos y la práctica en modelos animales.
Radiofrecuencia
La ablación por radiofrecuencia (RF) usando el sistema HALO® aplica energía térmica con una densidad prefijada. La penetración en el tejido es limitada a 500-1000 μm, lo que ha demostrado ser suficiente para la ablación del epitelio sin lesión de la capa submucosa en modelos animales y humanos. Esta energía puede aplicarse con dos tipos de catéteres diferentes, el HALO360® que es un catéter tipo balón, en el que en una extensión de 3 cm se hayan dispuestos 60 micro electrodos, o con el HALO90® que consiste en una placa de 2x1.3 cm colocada en el extremo del endoscopio, articulada, en la que se encuentran los microelectrodos[30]. El sistema HALO emplea corriente bipolar. Para aplicar el HALO360® es necesario realizar una medición del diámetro del esófago previamente, utilizando un catéter medidor, que se hincha y mide sucesivamente a intervalos de 1 cm, generalmente desde el cardias hasta 2 cm proximal al extremo más proximal del EB.
Con Halo 360 se emplea el protocolo ablación-eliminación del coágulo[31]. El “coágulo” (tejido blanquecino que queda adherido al esófago tras la primera ablación) se elimina mediante el raspado con una capucha plástica blanda especialmente diseñada a este efecto, que se coloca en el extremo del endoscopio. Con el HALO 90 se emplea el protocolo doble ablación-eliminación del coágulo-doble ablación. El catéter tipo balón se emplea generalmente en las primeras sesiones, cuando existe EB circunferencial de >2 cm. En sesiones sucesivas, cuando quedan sólo islotes aislados o EB circunferencial de <2 cm, suele emplearse el catéter tipo placa.
La técnica es muy segura, siendo prácticamente inexistentes los casos de perforación a pesar de haberse tratado ya un elevado número de pacientes.
En la actualidad, las terapias ablativas (de las que la radiofrecuencia es actualmente la más importante, habiendo desplazado a la terapia fotodinámica por su mejor perfil de seguridad y eficacia) se aplican en pacientes que ya han desarrollado displasia. En EB sin displasia la RF podría quizá justificarse en personas más jóvenes, y/o en aquellas con antecedentes familiares de adenocarcinoma esofágico. A pesar de ello, se estima que aproximadamente en la mitad de los pacientes tratados hasta el momento actual a nivel mundial con RF, la indicación era EB sin displasia. En el estudio más importante respecto a esta indicación, se erradicó el EB en 98% de los casos con un seguimiento a 30 meses, manteniéndose en 92% a 5 años[32].
Respecto a la displasia de bajo grado, el seguimiento endoscópico con toma de biopsias es la opción recomendada por las guías; se conoce que en la mayoría de los casos, la displasia no es confirmada cuando la biopsia la revisa un patólogo experto en neoplasia en EB[32]. Sin embargo, en el estudio más amplio hasta el momento que estudia la evolución de la displasia de bajo grado en EB, se observó que en aquellos casos confirmados por un patólogo experto, existía progresión en 13% de los casos anualmente, y en 85% a los 8 años[33]. Esto resalta la importancia del patólogo en el manejo de la displasia en EB, y obliga a reflexionar sobre la conveniencia del manejo conservador en la displasia de bajo grado, teniendo en cuenta la muy limitada disponibilidad de patólogos realmente expertos en estaárea en nuestro medio, donde el diagnóstico de displasia en EB es infrecuente. Algunas autoridades cuestionan la actitud conservadora frente a la displasia de bajo grado en EB, cuando por el contrario se recomienda la extirpación de cualquier lesión con displasia en el colon, aun conociendo el muy reducido riesgo de malignización de los adenomas diminutos con displasia leve[34]. En el momento actual existe al menos un estudio aleatorizado en marcha que compara el tratamiento de la displasia de bajo grado mediante RF, con el seguimiento endoscópico.
La indicación aceptada para el tratamiento con RF en EB es la displasia de alto grado. En las series del grupo de Amsterdam, la erradicación de displasia y metaplasia intestinal es del 100%[35], [36]. Otros estudios prospectivos muestran erradicación de la displasia en 70-100% de los casos, y del EB en 50-100%[1], [31]. Los resultados de estudios iniciales no eran tan buenos, debido a que sólo se disponía del catéter tipo balón.
Las complicaciones son infrecuentes y generalmente no graves: estenosis y laceraciones en aproximadamente 5% respectivamente. Por la elevada seguridad de la técnica, el procedimiento se realiza de forma ambulatoria. Existe la posibilidad de que persistan glándulas de EB enterradas bajo el epitelio neoescamoso, aunque incluso cuando se toman biopsias profundas es muy infrecuente[30], [31]. La mayoría de las recurrencias de EB ocurren en la región cardial.
Existen varios estudios prospectivos que han evaluado la eficacia y seguridad de la técnica. En el único estudio aleatorizado, se incluyeron 127 pacientes con displasia en EB, que se estratificaron por grado de displasia[37]. Se realizó tratamiento con radiofrecuencia, o se incluyeron en un grupo control (que se sometió a un procedimiento de tratamiento ficticio). Se evaluó la eliminación del EB y de la displasia a los 12 meses. La RF fue superior en todos los parámetros que se evaluaron, incluyendo la progresión a cáncer. En el grupo de tratamiento, frente al control hubo eliminación de la metaplasia intestinal en 77% vs 2%, de la displasia de bajo grado en 90% vs 23%, y de la displasia de alto grado en 81% vs 19%, respectivamente, siendo todas estas diferencias estadísticamente significativas. La progresión a cáncer se observó en 9% en el grupo control frente a 1% en el grupo de tratamiento. Hubo 6% de pacientes con estenosis, resultado muy inferior a lo comunicado con técnicas de resección. En el seguimiento a 3 años, se ha observado progresión a cáncer en los pacientes tratados con una frecuencia de 0.5% anualmente[38].
El grupo de Amsterdam propugna la resección por mucosectomía de las lesiones visibles, seguido de la RF del EB para evitar la aparición de lesiones sincrónicas o metacrónicas (tratamiento secuencial). En caso de displasia en mucosa plana, sin lesiones evidentes macroscópicamente, se realiza exclusivamente la RF. Se realizan hasta dos sesiones con HALO360® (hasta que desaparece el EB circunferencial)y hasta tres sesiones con HALO90®[30]. Con este protocolo han comunicado la erradicación de la displasia en 100% y regresión completa de la metaplasia intestinal en 96%[38]. Un estudio multicéntrico, aleatorizado, incluyó 47 pacientes con displasia de alto grado o cáncer precoz, en los que se realizó tratamiento secuencial o resección de todo el EB, tras haber realizado mucosectomía en lesiones visibles (en EB de hasta 5 cm); se observó similar eficacia en la eliminación de la displasia y del EB (ambas superiores al 90%), pero a expensas de que en la resección completa del EB se necesitó de media 6 sesiones (frente a 3 en el tratamiento secuencial), y con una mayor tasa de estenosis (88% vs 14%, como se explicó previamente)[21].
Sería deseable confirmar estos resultados con estudios más amplios, y con un seguimiento prolongado.
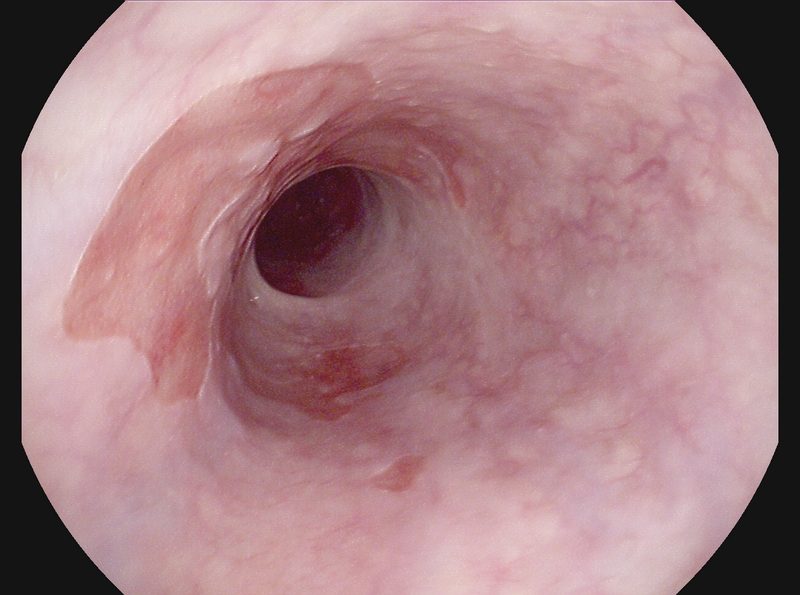
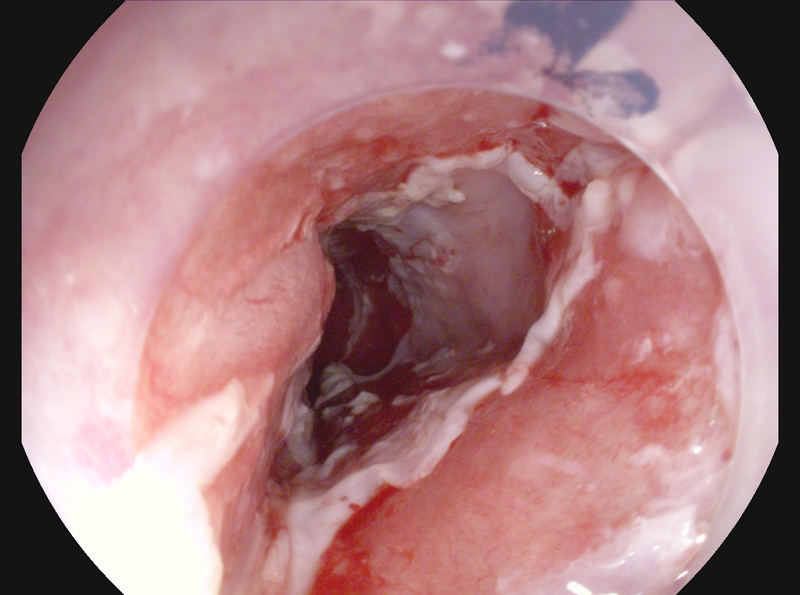
Algunos ejemplos del empleo de la radiofrecuencia en el EB se muestran en las figuras 3 y 4.

 Descargar número completo
Descargar número completo Download full issue
Download full issue